comportamiento de los ácidos y de las bases. Según ésta, una base sería una especie que puede donar electrones, y un ácido es la que acepta electrones. Para ello, el ácido debe tener su octeto de electrones incompleto, y la base debe tener algún par de electrones solitarios. El amoníaco es una base de Lewis típica y el trifluoruro de boro un ácido de Lewis típico. La reacción de un ácido con una base de Lewis da como resultado un compuesto de adición. Los ácidos de Lewis tales como el cloruro de aluminio, el trifluoruro de boro, el cloruro estánnico, el cloruro de zinc y el cloruro de hierro (III) son catalizadores sumamente importantes de ciertas reacciones orgánicas.
De esta forma se incluyen elementos que se comportan como ácidos pero no cumplen la definición de Brønsted y Lowry, y suelen ser denominadas ácidos de Lewis. Puesto que el protón, según esta definición, es un ácido de Lewis (tiene vacío el orbital 1s, en donde alojar el par de electrones), todos los ácidos de Brønsted-Lowry son ácidos de Lewis.
- Ejemplos de ácidos de Brønsted-Lowry: HCl, HNO3, H3PO4.
- Ejemplos de ácidos de Lewis: Ag+, H+, Sr2+, Hg2+.
Se puede tener una idea de la fuerza de una sustancia como ácido o base de Lewis utilizando la constante de disociación de su aducto con una base o ácido de Lewis tomado como referencia. Por ejemplo, para comparar la basicidad del amoníaco, metilamina, dimetilamina y trimetilamina en fase gaseosa, se puede utilizar el trimetilborano.
Constantes de disociación de los compuestos trialquilboro-amina a 100°C
| Ácido | Base | Kb |
|---|---|---|
| (CH3)3B | NH3 | 4.6 |
| (CH3)3B | CH3NH2 | 0.0350 |
| (CH3)3B | (CH3)2NH | 0.0214 |
| (CH3)3B | (CH3)3N | 0.472 |
Como ejemplo podemos tomar el caso de la protonación del amoniaco, que actúa como una base de Lewis al donar un par de electrones al agua, transferencia que lleva a su hidrólisis en oxhidrilo y protón, que es recibido por el amoníaco para formar amonio. Esto nos dice que una reacción ácido-base de Lewis es aquella en que existen donaciones de un par de electrones de una especie a otra sin cambios en los números de oxidación de las especies que interactúan. Al poner un ácido a una base, o una base a un ácido se neutralizaran. 1
Historia[editar]
El concepto se originó con Gilbert N. Lewis , quien estudió los enlaces químicos. En 1923, Lewis escribió «una sustancia ácida es una que puede emplear un par solitario de electrones de otra molécula para completar el grupo estable de uno de sus propios átomos». 23 La teoría ácido-base de Brønsted-Lowry fue publicada en el mismo año. Las dos teorías son distintas pero complementarias. Una base de Lewis es también una base de Bronsted-Lowry, pero un ácido de Lewis no necesita ser un ácido de Brønsted-Lowry. La clasificación en ácidos y bases duros y blandos (teoría ABDB) apareció en 1963. La fuerza de las interacciones ácido-base de Lewis, tal como se mide por la entalpía estándar de formación de un aducto puede ser predicha por la ecuación de dos parámetros de Drago–Wayland.

Gilbert Lewis fue un fisicoquímico estadounidense, que luego de veinticinco años estudiando las transformaciones químicas entre varias sustancias, en 1923, enunció una tesis basada en el par de electrones para las reacciones de ácidos-bases, conocida como Teoría de Lewis. De esta manera, completó las teorías existentes hasta ese momento, que habían sido propuestas por Arrhenius y Bronsted-Lowry.
Conjuntamente a este concepto, Lewis también introdujo el uso de fórmulas de los electrones representados por puntos y rayas diagonales, es así como su empleo en los diagramas químicos, se derivan de la teoría de los ácidos de Lewis, que a su vez, tomaron una gran importancia en la química orgánica.
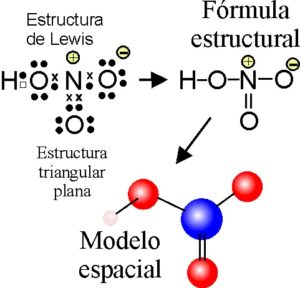
En esta tesis, un átomo es estable cuando presenta una valencia de ocho electrones, además, muchos compuestos pueden ser usados como catalizadores en diferentes síntesis, dando origen a varias sustancias que habían sido ignoradas por los preceptos anteriores, y que se reconocen como los ácidos de Lewis.
Cuáles son los ácidos de Lewis.

Generalmente, los ácidos de Lewis corresponden a metales, cationes y compuestos con aluminio o boro, entre algunos de ellos están los siguientes:
Cloruro de aluminio, es un compuesto de aluminio y cloro con propiedades anfóteras, es decir, puede actuar como ácido o como base.
Trifluoruro de boro, es un gas incoloro sumamente tóxico, y un ácido muy útil para la elaboración de otros compuestos del boro.
Dicloruro de zinc, aunque se conocen nueve prototipos de este elemento, comúnmente se presenta en formas de cristales blancos y siendo muy soluble en agua, constituye un excelente catalizador en la síntesis orgánica.
Percloruro de hierro, es un componente químico perteneciente a los haluros metálicos, muy usado a nivel industrial, que presenta un aspecto escamoso brillante que varía entre los colores verde oscuro y rojo púrpura, conformando un ácido débil empleado como catalizador en las síntesis orgánicas.
Definitivamente, se puede decir que los ácidos de Lewis, configuran una de las bases que formalizaron la química termodinámica moderna.
ángulo cónico de Tolman cuantifica el efecto estérico de las fosfinas. Dicho ángulo se define como el ángulo del vértice de un cono cilíndrico centrado a 2.28 Å del centro de un átomo de fósforo y que toca el radio de van der Waals de los átomos más externos del substituyente. En caso de que el substituyente pueda tener múltiples disposiciones espaciales se coloca de manera que forme el cono de menor tamaño.
Esta cuantificación es vital ya que el tamaño del ligando afecta a la reactividad del centro metálico. La tendencia de una fosfina a disociarse de un metal está directamente relacionada con su tamaño; lo que hace que sea muy importante en el ámbito de la catálisis para crear posiciones vacantes sobre el metal. Se encuentra un ejemplo concreto del efecto del tamaño de las fosfinas en la reacción de hidroformilación con compuestos de Rh y monofosfinas PR3, donde se observa que un aumento del ángulo cónico de Tolman conduce a una mayor selectividad en el aldehídolineal. Cuando el tamaño de la fosfina es demasiado grande la proporción de aldehído lineal decrece debido a efectos estéricos que impiden la formación especies con más de un ligando coordinado.
El término fue introducido por Chadwick A. Tolman, un químico investigador en Dupont. Originalmente aplicado a las fosfinas, los ángulos cónicos se determinaron originalmente tomando medidas a partir de precisos modelos físicos de ellos.123
Ángulos de Tolman[editar]
| ligando | angulo (grados) |
|---|---|
| PH3 | 87 |
| PH2Ph | 101 |
| P(OCH2)3CR | 101 |
| PF3 | 104 |
| P(OCH3)3 | 107 |
| dmpe | 107 |
| depe | 115 |
| P(CH3)3 | 118 |
| dppm | 121 |
| PMe2Ph | 122 |
| dppe | 125 |
| dppp | 127 |
| P(CH2CH3)3 | 132 |
| dcpe | 142 |
| P(C6H5)3 | 145 |
| PPh2(t-Bu) | 157 |
| P(cyclo-C6H11)3 | 170 |
| PPH(t-Bu)2 | 170 |
| P(t-Bu)3 | 182 |
| P(C6F5)3 | 184 |
| P(2,4,6-Me3C6H2)3 | 212 |
anillos o bandas de Liesegang son un fenómeno que se produce en numerosas reacciones de precipitación química, bajo determinadas condiciones de concentración y en ausencia de convección. En la naturaleza se encuentran ejemplos en rocas porosas o permeables, como estructuras diagenéticas, normalmente debidas a óxidos de hierro, siguiendo patrones concéntricos más o menos regulares.
Historia[editar]
El fenómeno fue descrito por primera vez en 1855 por el químico alemán Friedrich Ferdinand Runge en un trabajo profusamente ilustrado editado por él mismo,1 pero que pasó desapercibido. No fue hasta cuarenta años después, en 1896, cuando el también químico alemán Raphael E. Liesegang despertó la curiosidad de los químicos con su publicación sobre el fenómeno, al que acabaron dando su nombre.2 Liesegang lo observó cuando dejó caer un cristal de nitrato de plata sobre una delgada capa de gel que contenía dicromato potásico en la que, a los pocos días, se habían formado nítidos anillos concéntricos de dicromato de plata insoluble.3
Mecanismo de formación[editar]
El mecanismo preciso de la formación de los anillos de Liesegang no se conoce por completo y está todavía bajo investigación.4 Sin embargo, hay un proceso de precipitación que se piensa que es el catalizador para la formación de anillos de Liesegang, el denominado ciclo de sobresaturación-nucleación-agotamiento de Ostwald-Liesegang.5
Cuando se producen en un tubo de ensayo, por difusión de un componente desde la parte superior, en lugar de anillos se forman capas o bandas de precipitado.
Anillos de Liesegang en la naturaleza[editar]
En rocas sedimentarias pueden aparecer anillos o bandas de Liesegang que suelen atravesar las láminas y capas sedimentarias.6 Estas estructuras son secundarias, formadas durante la diagénesis, por la cementación de los poros con mineralizaciones de distinto color. En rocas ígneas y metamórficas permeables que se han alterado químicamente también pueden aparecer anillos compuestos de óxido de hierro.



No hay comentarios:
Publicar un comentario