reactivos de Grignard son compuestos organometálicos de fórmula general R-Mg-X, donde R es un resto orgánico (alquílico o arílico) y X un halógeno. Los reactivos de Grignard son unos de los más importantes y versátiles en química orgánica debido a su rápida reacción con electrófilos, como por ejemplo el grupo carbonilo. Son importantes para la formación de enlaces de carbono-carbono, carbono-fósforo, carbono-estaño, carbono-silicio, carbono-boro y otros enlaces carbono-heteroátomo.12 Por el descubrimiento de estos reactivos y sus reacciones, Victor Grignard recibió el premio Nobel de Química en 1912.
La reacción de Grignard generalizada es:
donde R1 = grupo orgánico alquilo o arilo
Síntesis[editar]
Los reactivos de Grignard se sintetizan a partir de un halogenuro de alquilo o arilo al reaccionar con magnesio en presencia de un éter anhidro (seco):
- RBr + Mg → RMgBr
Por ejemplo:
- CH3CH2Br + Mg → CH3CH2MgBr (bromuro de etilmagnesio)
Método experimental general:
Para que esta reacción tenga éxito, tanto los reactivos como el material utilizado deben estar completamente secos, y trabajar en atmósfera inerte. Sobre un matraz se coloca magnesio en forma de virutas o limaduras y se cubre con unos pocos mililitros del disolvente (dietil éter o tetrahidrofurano, generalmente; otra alternativa es el 2-Metiltetrahidrofurano más benigno con el medio ambiente). Se añade una pequeña cantidad de activante (usualmente dibromoetano o yodo) y, una vez activada la superficie del magnesio mediante la aplicación de calor, se comienza a adicionar la disolución del compuesto halogenado correspondiente previamente disuelto. Suele ser necesario calentar hasta que la reacción finaliza. Por último sólo es necesario filtrar la disolución (siempre bajo atmósfera inerte).
Para que tenga cierta estabilidad el reactivo de Grignard debe encontrarse solvatado.
Mecanismo[editar]
Mecánicamente la reacción de Grignard es una adición nucleófila en la que se añade el átomo de carbono polarizado negativamente (carbanión) del reactivo de Grignard al átomo de carbono de un grupo carbonilo. Por lo tanto, se forma un nuevo enlace carbono-carbono. Se cree que en el estado de transición de la reacción están involucradas dos moléculas del compuesto de Grignard, resultando un estado de transición de seis miembros cíclico. 3 El átomo de oxígeno del carbonilo del metal toma la forma de un alcóxido de metal. En el siguiente paso este átomo de oxígeno se protona por un ácido acuoso diluido y después se hidroliza por el ataque nucleófilo de una molécula de agua. Por desprotonación se produce el alcohol correspondiente.4
Reactividad general[editar]
Reacciones con compuestos carbonílicos[editar]
Los reactivos de Grignard reaccionan con una amplia variedad de compuestos carbonílicos. Aquí se muestra un esquema:
La aplicación más común de este tipo de reacción usada en la industria consiste en alquilar aldehídos o cetonas, como en el ejemplo:5
El grupo funcional acetal, un carbonilo protegido, no reacciona con el organomagnesiano.
Tales reacciones por lo general implican un tratamiento ácido acuoso, aunque esto rara vez se muestra en los esquemas de reacción. En los casos en que el reactivo de Grignard es la adición de un aldehído o cetona proquiral (por inducción asimétrica), el modelo Felkin-Anh o la regla de Cram pueden predecir qué estereoisómero se formará generalmente. Con facilidad, las 1,3-dicetonas y otros sustratos relacionados, los reactivos de Grignard RMgX reaccionan simplemente como una base, dando el anión enolato y liberando el alcano RH.
Reacción con otros electrófilos[editar]
Los reactivos de Grignard reaccionan con diversos electrófilos, actuando tanto como un nucleófilo para muchos casos y como una base para sustratos próticos:
Formación de enlaces con B, P, Si, Sn[editar]
Igual que los compuestos de organolitio, los reactivos de Grignard son útiles para la formación de enlaces carbono-heteroátomo:
Reacción con halogenuros de metales de transición[editar]
Los reactivos de Grignard reaccionan con muchos electrófilos metálicos. Por ejemplo, se produce la transmetalación al hacerlos reaccionar con cloruro de cadmio (CdCl2) para dar compuestos organometálicos de dialquilcadmio:6
Los compuestos organometálicos de dialquilcadmio se utilizan sobre todo en la preparación de cetonas a partir de haluros de ácido:
Reacciones de acoplamiento C-C[editar]
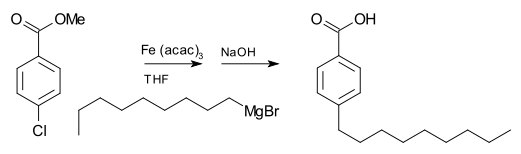
Un reactivo de Grignard también puede participar en una reacción de acoplamiento. Por ejemplo, el bromuro de nonilmagnesio reacciona con metil p-clorobenzoato para dar ácido p-nonilbenzoico, en presencia de tris(acetilacetonato) de hierro (III) (Fe(acac)3), después del tratamiento con NaOH para hidrolizar el éster, que se muestra de la siguiente manera.7 Sin el Fe(acac)3, el reactivo de Grignard atacaría al grupo éster.
Para el acoplamiento de haluros de arilo con reactivos de Grignard de arilo, el cloruro de níquel en tetrahidrofurano (THF) es un buen catalizador. Adicionalmente, un catalizador eficaz para los acoplamientos de haluros de alquilo es el tetraclorocuprato de dilitio (Li2CuCl4), preparado por mezcla de cloruro de litio (LiCl) y cloruro de cobre (II) (CuCl2) en THF. El acoplamiento de Kumada-Corriu da acceso a estirenos (sustituidos):
Sustitución nucleófila alifática[editar]
Los reactivos de Grignard son nucleófilos y pueden dar reacciones de sustitución nucleófila con halogenuros de alquilo, por ejemplo en un paso clave en la producción industrial de naproxeno:
Reacción de Grignard estereoselectiva[editar]
Dado que muchas cetonas y todos los aldehídos son proquirales (excepto el formaldehído), como resultado en una reacción de Grignard a menudo se obtienen pares de enantiómeros o diastereómeros debido al centro estereogénico ya existente. Para extender la reacción de Grignard de forma estereoselectiva, Dieter Seebach usó el reactivo quiral TADDOL, un derivado del ácido tartárico. Aprovechando el equilibrio de Schlenk en la reacción con aldehídos se lograron del 84 al 96% de exceso enantiomérico.
El reactivo de Neßler es un reactivo químico usado para detectar pequeñas cantidades de amoníaco (azano, H3N) o catión amonio (H4N+). Debe su nombre a su descubridor, el químico alemán Julius Neßler que lo publicó en su tesis doctoral de 1856.
Consiste en una solución 0,09 M de tetrayodomercuriato (II) de potasio (K2[HgI4]) en una solución 2,5 M de hidróxido de potasio (KOH). En presencia de amoníaco o catión amonio, toma coloración amarilla-naranja y en grandes concentraciones se forma un precipitado color naranja.
Preparación[editar]
Una forma de preparar el reactivo es disolver 10g de yoduro de potasio (KI) por cada 10ml de agua, agregando una solución saturada (60g/L) de cloruro mercúrico (HgCl2) en pequeñas proporciones y agitando, hasta formación permanente de un leve precipitado. Luego se agregan 80 ml de solución de hidróxido de potasio (KOH) y se diluye a 200 ml. Se deja en reposo durante la noche y se decanta el líquido claro.
Otro método para prepararlo es disolver 23 g de yoduro mercúrico y 16 g de yoduro de potasio en agua y se lleva a 100 ml. Se agrega 100 ml de hidróxido de sodio 6 N. Se deja en reposo durante 24 horas y se decanta la solución para separar cuialquier precipitado que se hubiere formado.
La reacción de formación del reactivo de Neßler es la siguiente:
2 KI + HgI2 = K2[HgI4]
Reacción[editar]
La técnica de reacción a la gota es la siguiente: se mezcla sobre un vidrio de reloj una gota de la solución en análisis con una gota de solución concentrada de hidróxido de sodio. Se lleva una microgota de la solución o suspensión resultante a un papel para reaciones a la gota y se agrega una gota de reactivo de Neßler y se observa una mancha o anillo amarillo o anaranjado rojizo. La sensibilidad de esta reacción es de 0,3 μg de H3N.1
La reacción del reactivo con amoníaco es:
2 K2[HgI4] + 3 KOH + H3N = HgI (H2N) . HgO + 7 KI + 2 H2O
Con catión amonio, la ecuación iónica sería:
2 [HgI4]2- + 4 OH- + H4N+ = HgI (H2N) . HgO + 7 I- + 3 H2O
Toxicidad[editar]
El reactivo es tóxico, tanto si es inhalado, tragado o absorbido por la piel. Esto se debe a que contiene mercurio. Presenta peligro neurológico y puede actuar como carcinógeno y ser un riesgo para la reproducción. Es corrosivo y causa quemaduras.








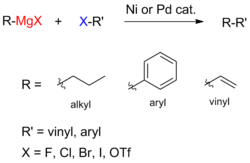


No hay comentarios:
Publicar un comentario