Fusibilidad es la facilidad con que un material puede derretirse o fundirse. Es la propiedad que permite obtener piezas fundidas o coladas.
Algunos tipos de materiales, en ciertos tipos de soldadura, requieren un bajo punto de fusión de forma que cuando el calor es aplicado al material, el material aportado a la soldadura se derrite antes que el material a soldar siendo esto, una "alta fusibilidad del material aportado" con respecto al material a soldar.
Por otra parte, existen otros materiales que son utilizados en instrumentos (como algunos hornos especiales)que se les aprovecha su baja fusibilidad. Los materiales que sólo se derriten a temperaturas muy altas se les llama materiales refractarios.
En química, el proceso de Haber o proceso de Haber - Bosch es la reacción de nitrógeno e hidrógenogaseosos para producir amoníaco. La importancia de la reacción radica en la dificultad de producir amoníaco a un nivel industrial.
Alrededor del 78,1% del aire que nos rodea es nitrógeno molecular, N2. El elemento como moléculadiatómica gaseosa es muy estable y relativamente inerte debido al enlace triple que mantiene los dos átomos fuertemente unidos. No fue sino hasta los primeros años del siglo XX cuando este proceso fue desarrollado para obtener nitrógeno del aire y producir amoníaco, que al oxidarse forma nitritos y nitratos. Estos son esenciales en los ácido nítrico (HNO3) y fertilizantes (ejemplo: nitrato de amonio (NH4NO3)).
Como la reacción natural es muy lenta, se acelera con un catalizador de hierro (Fe3+) y óxidos de aluminio (Al2O3) y potasio (K2O) permitiendo que el equilibrio se alcance con mayor rapidez. Los factores que aumentan el rendimiento, al desplazar el equilibrio de la reacción hacia los productos (Principio de Le Châtelier), son las condiciones de alta presión (150-300 atmósferas) y altas temperaturas (400-500 °C),1 resultando en un rendimiento del 10-20%.
ΔH representa la variación de temperatura, también llamado entalpía, y equivale a -92,4 kJ/mol. Al ser negativa, libera calor, por lo que la reacción es exotérmica.
Historia[editar]
El proceso fue patentado por Fritz Haber. En 1910, Carl Bosch comercializó el proceso y aseguró aún más patentes. Haber y Bosch fueron galardonados con el Nobel de Química en 1918 y 1931 respectivamente, por sus trabajos y desarrollos en la aplicación de la tecnología en altas presiones y temperaturas. El amoníaco fue producido utilizando el proceso Haber (a un nivel industrial) durante la Primera Guerra Mundial para su uso en explosivos. Esto ocurrió cuando el abasto de Chile estaba controlado casi en un 100% por los británicos.
Aspectos económicos y ambientales[editar]
El proceso Haber produce más de 100 millones de toneladas de fertilizante de nitrógeno al año. El 8,27% del consumo total de energía mundial en un año se destina a este proceso.[cita requerida] Los fertilizantes que se obtienen son responsables tanto del sustento de más de un tercio de la población mundial debido a que la extracción de nutrientes del suelo por parte de la agricultura y ganadería es cuantiosa y por ende deben ser repuestos de manera artificial, aunque el mal uso de los fertilizantes producen numerosos problemas ambientales por la erosión y el escurrimiento de nutrientes a napas y cuerpos de agua siendo el más emblemático la eutrofización.
El impacto ambiental[editar]
Solo el 17% del amoniaco usado como fertilizante es consumido por los humanos a través de la comida. El resto acaba en la tierra o en el aire. Según un artículo de Nature Geoscience, las emisiones en ausencia de interferencia humana son de 0,5 kg por hectárea y año. La agricultura moderna ha multiplicado por 20 esta cifra, lo que ha provocado la alteración del ciclo natural del nitrógeno aunque su impacto global aún no es muy conocido.
Hay dos problemas directamente relacionados con el amoniaco. Uno es el de la eutrofización de las aguas. Los nitratos acaban en mares y ríos, las algas y bacterias con exceso de nutrientes, acaban con el oxígeno que necesitan otras especies. Por otro lado, el nitrógeno reactivo está alterando el balance atmosférico, enriqueciendo el ozono de la troposfera y reduciendo el de la estratosfera. Eso sí, el amoniaco tiene el efecto positivo de la captura de CO2 en selvas y bosques debido a la mayor presencia de nitrógeno en el aire.
hidrodesulfuración (HDS) o hidrodesulfuración térmica (HDT) es un proceso químico catalítico destinado a eliminar el azufre (impureza contaminante) que se encuentra en el gas natural y de los productos refinados del petróleo, tales como gasolina o gasolina, combustible del jet, queroseno, combustible diesel, y fuel oils.12y que se instala antes de los procesos que pueden ver afectados sus catalizadores como el reformado.
Este azufre se encuentra combinado formando componentes químicos que, de ser encontrados en los combustibles en el motor en el momento de la combustión, este se corroería y al mismo tiempo, al ser expulsados los gases, contaminarían el ambiente.
El nivel de hidrodesulfuración depende de varios factores entre ellos la naturaleza de la fracción de petróleo a tratar (composición y tipos de compuestos de azufre presentes), de la selectividad y actividad del tipo de catalizador utilizado (concentración de sitios activos, propiedades del soporte, etc.), de las condiciones de reacción (presión, temperatura, relación hidrocarburo/hidrógeno, etc.) y del diseño del proceso. Es importante señalar que el H2S debe ser continuamente eliminado porque es un inhibidor de las reacciones de HDS y envenena el catalizador.
Proceso[editar]
Los procesos convencionales de hidrodesulfuración constan básicamente de un sistema de reacción donde los compuestos orgánicos de azufre reaccionan con el hidrógeno para obtener compuestos orgánicos y ácido sulfhídrico, un sistema de separación para eliminar los compuestos ligeros (i.e. H2, H2S e hidrocarburos ligeros) del diesel y un sistema de recirculación, existen diversas tecnologías basadas en esta configuración.
El sistema de reacción consta usualmente de reactores empacados de tres fases, son llamados así porque se encuentran presentes la fase líquida (gasóleo), la fase gas (H2 y H2S) y la fase sólida (catalizador). Estos son operados a co-corriente, es decir, la fase líquida y gas fluyen en la misma dirección y la masa de catalizador, tipo cobalto/molibdeno sobre alúmina, se mantiene fija.
Compuestos de azufre[editar]
Las corrientes del petróleo (naftas, keroseno, gasóleos ligeros y pesados) contienen una gran cantidad de compuestos orgánicos de azufre, tales como el tiol, tiofeno, benzotiofeno, dibenzotiofeno y naftodibenzotiofeno. Estos compuestos varían en su reactividad a la HDS y en su proporción en las corrientes del petróleo.
Las legislaciones ambientales en referencia a los límites máximos permisibles de determinados compuestos son cada vez más rígidas, en particular el contenido máximo de azufre en algunos países europeos no debe exceder las 10 partes por millón (combustibles limpios).
hidrometalurgia es la rama de la metalurgia que cubre la extracción y recuperación de metales usando soluciones líquidas, acuosas y orgánicas.
Se basa en la concentración de soluciones en uno a varios elementos de interés metales, presentes como iones, que por reacciones reversibles y diferencias físicas de las soluciones son separados y aislados de forma específica. Como resultado se obtiene una solución rica en el ion de interés y con características propicias para la próxima etapa productiva.
En general los metales extraídos por esta técnica son provenientes de los minerales anteriormente lixiviados en medios sulfato, cloruro, amoniacal, etc. Metales como cobre, níquel, vanadio, cromo y uranio, son extraídos de esta forma. Por ese último metal se dio comienzo a la Hidrometalurgia durante el auge de la industria nuclear apoyada económicamente por la segunda guerra y posteriormente guerra fría.
Los procesos hidrometalúrgicos normalmente operan a temperaturas bajas (en el rango de 25 a 250 °C). Las presiones de operación pueden variar de unos pocos kPa (kilopascales) (vacío) hasta presiones tan altas como 5000 kPa.
El punto fuerte de la hidrometalurgia radica en la gran variedad de técnicas y combinaciones que pueden ser usadas para separar metales una vez que han sido disueltos a la forma de iones en solución acuosa.
El proceso hidrometalúrgico más importante es el colado, mediante el cual el mineral deseado se va disolviendo selectivamente, aunque comúnmente también son frecuentes los procesos de lixiviación y biolixiviación dentro de la metalurgia contemporánea.
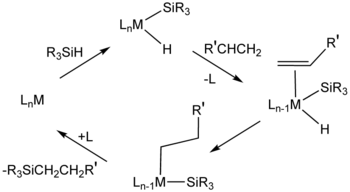
hidrosililación, también llamado hidrosilación catalítica, describe la adición de enlaces Si-H a través de enlaces insaturados. Normalmente la reacción se lleva a cabo catalíticamente y por lo general los sustratos insaturados son compuestos orgánicos. Los alquenos y los alquinos dan alquilos y silanos de vinilo; aldehídos y cetonas dan éteres de sililo. La hidrosililación se ha llamado la "aplicación más importante de platino en catálisis homogénea".1 El proceso fue reportado por vez primera en la literatura científica en 19472 y fue anunciada por primera vez en 1972.

Ámbito de aplicación y el mecanismo[editar]
La transformación catalítica representa un importante método para la preparación de compuestos orgánicos de silicio. Una transformación idealizada se ilustra mediante la adición de trietilsilano a difenilacetileno:4
- Et3SiH + PhC≡CPh → Et3Si(Ph)C=CH(Ph)
La reacción se relaciona mecánicamente a hidrogenación , y catalizadores similares se emplean a veces para los dos procesos catalíticos. En la industria "catalizador de Speier," ácido cloroplatínico (H2PtCl6) es importante.5 El mecanismo por lo general supone un complejo de metal intermedio que contiene un hidruro, un enlace sililo (R3Si), y el alqueno o alquino del sustrato.
Estas reacciones también puede ser catalizada utilizando catalizadores a base de nanomaterial.
hidrosililación asimétrica[editar]
Usando fosfinas quirales como espectador ligando s, catalizadores se han desarrollado para hidrosilación asimétrica catalítica. Una reacción bien estudiado es la adición de triclorosilano al estireno para dar 1-fenil-1-(triclorosilil) etano:
- Cl3SiH + PhCHCH2 → (Ph)(CH3)CHSiCl3
Se puede lograr una casi perfecta enantioselectividades (ee) utilizando catalizadores de paladio soportados por binaftilo sustituidos con enlaces monofosfina.6
Hidrosililación de superficie[editar]
Las obleas de silicio se pueden grabar con ácido fluorhídrico (HF) para eliminar el óxido nativo, y forman una superficie de silicio terminado en hidrógeno. A continuación, las superficies terminadas en hidrógeno puede reaccionar con compuestos insaturados (tales como alquenos y alquinos terminales), para formar una monocapa estable sobre la superficie. Por ejemplo:
H:Si(100) + CH=CH(CH2)7CH3 → Si(100)-(CH2)9CH3
La reacción de hidrosililación se puede iniciar con luz UV a temperatura ambiente, o con aplicando calor (temperatura de reacción típica de 120-200 grados C), en virtud de las condiciones de humedad y del oxígeno libre.78
La monocapa resultante es estable e inerte, y evitar la oxidación de la capa de silicio base. La superficie de este tipo podría encontrar aplicaciones en áreas como la electrónica molecular, bioquímica y sensores electrónicos directos de biomoléculas.

No hay comentarios:
Publicar un comentario