El efecto Jahn-Teller, en magnetoquímica, se da en sistemas (generalmente compuestos de coordinación de metales de transición) en los que hay varios niveles de energía degenerados y no igualmente ocupados. En estos casos, el teorema de Jahn-Teller predice que el sistema experimentará una distorsión, de forma que algunos de estos niveles se estabilizarán y otros se desestabilizarán. Al no estar todos los niveles igualmente ocupados, los desestabilizados serán los más vacíos, y el sistema tendrá una ganancia neta de energía. El teorema no predice cuán intenso será el efecto en cada caso particular.
Este efecto electrónico fue propuesto por Hermann Arthur Jahn y Edward Teller, que demostraron, usando la teoría de grupos, que las moléculas no lineales con estados electrónicos degenerados no podían ser estables.1
Este efecto es importante, por ejemplo, en el caso de las sales y los complejos octaédricos de cobre(II). Este catión tiene una población electrónica d9, y, por tanto, un estado fundamental de simetría eg (un orbital con dos electrones y otro con uno). La distorsión de la simetría octaédrica para dar un octaedro elongado axialmente, por ejemplo, estabiliza el orbital dx2-y2, que queda ocupado por dos electrones y desestabiliza el dz2, que queda ocupado por un electrón. La distorsión que se da más a menudo es la elongación de los enlaces metal-ligando que se encuentran en el eje z, aunque también se pueden acortar estos enlaces; ya que el teorema Jahn-Teller prevé la existencia de una geometría inestable, pero no predice la dirección en la que se efectúa.
La elongación se produce para rebajar la repulsión electrostática entre el par de electrones del ligando y los electrones que se encuentran en los orbitales del metal que tengan una componente z.
En complejos octaédricos, el efecto Jahn-Teller es más pronunciado cuando un número impar de electrones ocupa los orbitales eg como en: d9, d7 de espín bajo o el d4de espín alto. Esto se debe a que los orbitales eg se encuentran en la misma dirección que los ligandos, así pues la distorsión representa una gran estabilización energética. El efecto es mucho menor cuando los electrones degenerados se encuentran en los orbitales t2g, porque estos no están en la misma dirección que los ligandos, por lo tanto las repulsiones son menores. En complejos tetraédricos, la distorsión es la misma que en el último caso, donde la distorsión también es menor, ya que los ligandos tampoco están señalando directamente a los orbitales. También existe este efecto en complejos d8 con geometría cuadrado planar (hibridación dsp2), en donde los orbitales dz2, dxz y dyz son los de más baja energía.
Los efectos esperados para complejos octaédricos se encuentran en la siguiente tabla:
| Número de electrones d | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|
| espín alto | d | d | f | d | d | f | ||||
| espín bajo | - | - | d | d | f | - |
El efecto jahn teller se produce por una alta presión de los átomos que hacen que el metal se convierta de aislante a superconductor
d: efecto Jahn-Teller débil (t2g orbitales semillenos)
f: efecto Jahn-Teller fuerte (eg orbitales semillenos)
blanco: no se espera efecto Jahn-Teller
-: no existe esta situación de espín para esta configuración electrónica.
electrólisis de Kolbe o reacción de Kolbe es una reacción orgánica que consiste en la descarboxilaciónelectrolítica de un ácido carboxílico en medio básico en el cual se forma el alcano dímero de los sustituyentes del carboxilo originales. Fue denominada así en honor al químico alemán Adolph Wilhelm Hermann Kolbe.12
La reacción se lleva a cabo por un mecanismo de radicales libres:3
- CH3COOH → CH3COO− → CH3COO· → CH3· + CO2
- 2CH3· → CH3CH3
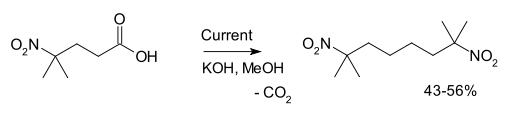
Otro ejemplo es la síntesis de 2,7-dimetil-2,7-dinitrooctano a partir de ácido 4-metil-4-nitrovalérico:4
- epoxidación de Sharpless, llamada así en honor del químico estadounidense K. Barry Sharpless, es una reacción química enantioselectiva utilizada para preparar 1,3-epoxialcoholes a partir de alcoholes alílicosprimarios y secundarios.12 La estereoquímica del epóxido resultante está determinada por el diastereómero de dietil tartrato utilizado en la reacción. Esta reacción proporciona buenos rendimientos y diastereoselectividad en un amplio rango de sustratos.El agente oxidante es el tert-butil hidroperóxido, mientras que la enantioselectividad está garantizada por el catalizador formado a partir del tetraisopropóxido de titanio y el dietil tartrato. Sólo se necesitan entre 5 y 10 mol% del catalizador en presencia de un tamiz molecular de 3Å.3Los epóxidos resultantes pueden ser fácilmente transformados en dialcoholes, aminoalcoholes o éteres, por lo que la formación de epóxidos quirales es un paso fundamental en la síntesis de productos naturales y de medicamentos. Esta reacción fue clave para la consecución del premio Nobel de química de 2001 otorgado a K. Barry Sharpless, junto a William S. Knowles y Ryoji Noyori.
- El equilibrio de Gibbs - Donnan es el equilibrio que se produce entre los iones que pueden atravesar la membranay los que no son capaces de hacerlo. Las composiciones en el equilibrio se ven determinadas tanto por las concentraciones de los iones como por sus cargas.
-
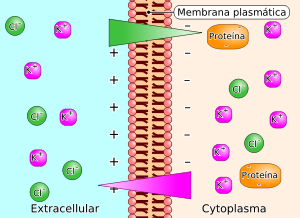
Esquema para el equilibrio de Gibbs - Donnan.
Fundamento[editar]
Cuando partículas de gran tamaño cargadas eléctricamente, como las proteínas, que no se difunden a través de una membrana semipermeable están presentes en un compartimento fluido como el vascular, atraen los ionescargados positivamente y repelen los iones cargados negativamente (tal y como aparece en la figura). Como consecuencia de ello, se establece un gradiente eléctrico y sendos gradientes de concentración de los iones, estos dos últimos iguales y de signo opuesto. En el equilibrio, los productos de las concentraciones iónicas de cada lado de la membrana son iguales. En consecuencia, la concentración de partículas es desigual a ambos lados de la membrana y se establece un gradiente osmótico en dirección hacia el compartimiento que contiene las proteínas. Esta presión osmótica en el equilibrio de Gibbs-Donnan es de unos 6-7 mm de Hg. El efecto de Donnan sobre la distribución de los iones difusibles es importante en el organismo a causa de la presencia en las células y en el plasma.Equilibrio de Membrana de Donnan[editar]
El equilibrio de membrana de Donnan se basa en que a un lado de la membrana hay que "aplicar" una disolución "por ejemplo" cloruro sodico y al otro lado de la membrana un electrólito cargado negativamente, los iones que son de signo contrario pasan a través de la membrana, y los iones de cloruro y de sodio pasan sin ninguna dificultad por la membrana, los iones de las partículas aniónicas no pasan teniendo un equilibrio a lo largo de la membrana, como existe un equilibrio los volúmenes en la disolución a ambos lados de la membrana son idénticos, la actividad de sal o concentración del cloruro sódico es la misma, por lo tanto, obedece al principio de tendencias de escape:Sin embargo no es la única condición que se cumple, debe cumplir la condición de electro neutralidad, esta condición nos dice que:La concentración de los iones cargados positivamente en las disoluciones, a ambos lados de la membrana tiene que equilibrarse con la concentración de los iones de carga negativa , tal y como aparece a continuaciónAl exterior de la membranaAl interior de la membrana"siendo R los iones de los electrolitos"Estas ecuaciones al introducirlas en la primera nos dan como resultado:La razón de las concentraciones del anión difusible fuera y dentro de la membrana semipermeable depende de la concentración del polielectrolito que con carga negativa se encuentra en el interior del saco semipermeable, tratando de llevar iones de carga similar a la del agua hacia el exterior de la membrana. Cuando es grande comparada con la razón es, aproximadamente, igual a:Si, por el contrario, es bastante grande con respeto a la razón de la ecuación se hace casi igual a la unidad, y entonces la concentración de la sal es prácticamente la misma a ambos lados de la membrana.Distribución de la membrana[editar]
Ahora si la distribución de cargas en la membrana es distinta se produce un potencial en dicha membrana(potencial de donnan) el cual para que este en equilibrio se requiere:donde dicho índice nos indica que el potencial debe ser una propiedad intensiva del sistema dependiente de la concentración y del potencial eléctrico generado por las cargas.Dado que el primer coeficiente es diferente de cero, lo que hace que la solución sea continua en todo el plano, entonces despejando la derivada direccional del potencial eléctrico e integrando la ecuación anterior nos resulta:e integrando para la anterior ecuación se obtiene:Implicación del equilibrio de Gibbs - Donnan[editar]
Lo que implica que la concentración de cargas dentro y fuera de la membrana debe poseer una estabilidad asociada en cuanto a la concentración de los iones en ambos lados es más si se considerase la membrana semipermeable como un agente catalizador produciría un gradiente de concentración en la membrana y sin embargo el equilibrio seria establecido así:




![[Na^{+}]_{e}[Cl^{-}]_{e}=[Na^{+}]_{i}[Cl^{-}]_{i}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78de550e278d674b22cf9cc878027efe63d89a53)
![[Na^{+}]_{e}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc2b661ca27ba4e146815cb7b5243921858cbde7)
![[Cl^{-}]_{e}](https://wikimedia.org/api/rest_v1/media/math/render/svg/404bd34ea5b2e8e497a31893ba5751d62ffb525b)
![[Na^{+}]_{e}=[Cl^{-}]_{e}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f6c483dc7146e1981ca794258c27faabfd60b3b)
![[Na^{+}]_{i}=[R^{-}]_{i}+[Cl^{-}]_{i}](https://wikimedia.org/api/rest_v1/media/math/render/svg/633b9fa45392b1262bdab50c0c372db378c870ea)
![\frac{[Cl^{-}]_{e}}{[Cl^{-}]_{i}}=\sqrt{1+\frac{[R^{-}]_{i}}{[Cl^{-}]_{i}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/03693347ad9c10d73e72a57b15b8ec4b6e7c9e95)
![[R^{-}]_{i}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e7873c7a463a766427edb4fc83859456a77e4180)
![[Cl^{-}]_{i}](https://wikimedia.org/api/rest_v1/media/math/render/svg/759550ba325d4fa4da72a5e4ce7609adf02d6561)
![\sqrt{[R^{-}]_{i}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e64228207b457d64e333a01dcfb61f70cc62fe8a)





No hay comentarios:
Publicar un comentario