anomalía de Schottky, en las medidas de calor específico, se encuentra en materiales con niveles de energía de espín.
A bajas temperaturas, los materiales cristalinos presentan una dependencia de la capacidad caloríficaaproximadamente proporcional al cubo de la temperatura. Esta capacidad calorífica corresponde a la población de fonones (vibraciones colectivas de la red).
Un compuesto magnético (que presente interacciones magnéticas) tendrá, superpuesta a esta función, un pico de baja intensidad, correspondiente a la temperatura a la que se pueblan los niveles de energía magnéticos.
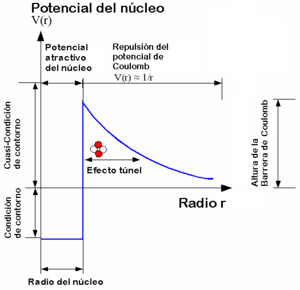
La barrera de Coulomb, denominada a partir de la ley de Coulomb, nombrada así por el físico Charles-Augustin de Coulomb (1736-1806), es la barrera de energía debida a la interacción electrostática que el núcleo atómico debe superar para experimentar una reacción nuclear.1 Esta barrera de energía es proporcionada por la energía potencial electrostática:
donde:
- k es la constante de Coulomb = 8.9876×109 N m² C−2;
- ε0 es la permeabilidad en el vacío;
- q1, q2 son las cargas de las partículas que interactúan;
- r es el radio de interacción.
Un valor positivo de U es debido a una fuerza de repulsión, así que las partículas que interactúan están a mayores niveles de energía cuando se acercan. Un valor negativo de la energía potencial U indica un estado de ligadura, debido a una fuerza atractiva.
La barrera de Coulomb aumenta con el número atómico, o sea, con el número de protones del núcleo en colisión:
donde e es la carga elemental, 1.602 176 53×10−19 C, y Zi los correspondientes números atómicos.
Para superar esta barrera, el núcleo tiene que colisionar a altas velocidades, para que las energías cinéticas permitan que opere la interacción nuclear fuerte y una las partículas.
Según la teoría cinética de los gases, la temperatura de un gas es solo una medida de la velocidad media de las partículas en ese gas. Para gases habituales, la distribución de Maxwell-Boltzmann proporciona la fracción de partículas que se mueven a una determinada velocidad como función de la temperatura, y así podemos obtener la fracción de partículas que se mueven a velocidades suficientemente altas para superar la barrera de Coulomb.2
En la práctica, las temperaturas necesarias para superar la barrera de Coulomb resultan ser menores de las esperadas debido al efecto túnel cuántico, como fue establecido por Gamow.123 La consideración de barrera-penetración mediante el efecto túnel y la distribución de velocidades dan lugar a un número limitado de condiciones en las que la fusión puede llevarse a cabo, conocido como Pico de Gamow.
base de Schiff' (o azometino), nombrado así en honor a Hugo Schiff, es un grupo funcional que contiene un enlace doble carbono-nitrógeno, con el átomo de nitrógeno conectado a un grupo arilo o alquilo, pero sin hidrógeno.1 Las bases de Schiff tienen la fórmula general R1R2C=N-R3, donde R3 es un grupo arilo o alquilo que hace que la base de Schiff sea una imina estable. Una base de Schiff derivada de una anilina, donde R3 es un fenilo o fenilo sustituido, puede ser denominado anil.2
Las bases de Schiff pueden ser sintetizadas a partir de una amina aromática y un compuesto de carbonilo por adición nucleofílica, formando un hemiaminal, seguido por una deshidratación para generar una imina. En una reacción típica, el 4,4'-diaminodifenil éter reacciona con o-vanillina:
proceso electrolítico Betts es un proceso industrial para la purificación de plomo a partir de lingotes. El plomo obtenido a partir de sus menas es bastante impuro porque el plomo es un buen disolvente para muchos metales. A menudo, estas impurezas son toleradas, pero el proceso electrolítico Betts se utiliza cuando se requiere plomo de alta pureza, especialmente libre de bismuto.1
Es nombrado por el químico estadounidense Anson Gardner Betts (1876-1976), que obtuvo varias patentes a partir de 1901.
Descripción del proceso[editar]
El electrolito para este proceso es una mezcla de fluorosilicato de plomo (PbSiF6) y ácido hexafluorosilícico (H2SiF6) que opera a 45 °C . Los cátodos son hojas delgadas de plomo puro y los ánodos son emitidos desde el plomo impuro a purificar. Se aplica un potencial de 0,5 voltios. En el ánodo, el plomo se disuelve en la disolución, al igual que las impurezas de metales que son menos nobles que el plomo. Las impurezas que son más nobles que el plomo, tales como plata, oro y bismuto, forman copos desde el ánodo a medida que se disuelve y se depositan en el fondo de la vasija como "lodo anódico." El plomo se deposita en las placas de plomo metálico en el cátodo, los metales menos nobles permanecen en la solución. Debido al alto coste de la electrólisis, este proceso se utiliza sólo cuando se necesita plomo de alta pureza. De lo contrario se prefieren los métodos pirometalúrgicos, tales como el proceso Parkes seguido por el proceso Betterton-Kroll.
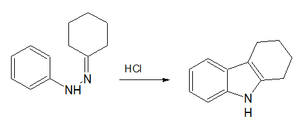
En el primer paso, la fenilhidrazina es condensada con ciclohexanona para formar la base de Schiffcorrespondiente. El segundo paso, catalizado por ácido clorhídrico, consiste en una transposición con ciclizaciónpara formar tetrahidrocarbazol.3
Si se desea el carbazol aromático, el tetrahidrocarbazol se puede oxidar con tetróxido de plomo.

catalizador de Adams, también conocido como dióxido de platino, se suele representar como un hidrato del óxido de platino (IV), PtO2-H2O. Es un catalizador para hidrogenación e hidrogenolisis en síntesis orgánica. Este polvo de color marrón oscuro está disponible comercialmente. El propio óxido no es un catalizador activo, pero se activa después de la exposición al hidrógeno por lo cual se convierte en negro de platino, el cual es el funge como catalizador de las reacciones.
Preparación[editar]
El catalizador de Adams se prepara a partir del ácido cloroplatínico H2PtCl6 o del cloroplatinato de amonio, (NH4)2PtCl6, con fusión con el nitrato de sodio. Se preparó por primera vez por V. Voorhees y Roger Adams.2 El procedimiento consiste primero en la preparación de un nitrato de platino que se calienta con el fin de expulsar los óxidos de nitrógeno.3
-
- H2PtCl6 + 6 NaNO3 → Pt(NO3)4 + 6 NaCl (aq) + 2 HNO3
- Pt(NO3)4 → PtO2 + 4 NO2 + O2
La torta resultante se lava con agua para eliminar los nitratos. El catalizador puede ser utilizado tal cual o seco, y se almacena en un desecador para su uso posterior. El platino puede ser recuperado de catalizador usado por la reconversión a cloroplatinato de amonio empleando agua regia y amoníaco. Cuando se utiliza para oxidación, tiene la siguiente estequiometría:
-
- PtO2 + 4[H] → Pt + 2 H2O
Usos[editar]
El catalizador de Adams se utiliza para diversas aplicaciones. Ha demostrado ser valioso para la hidrogenación, hidrogenólisis, deshidrogenación y oxidación. Durante la reacción, el metal de platino con hidrógeno adsorbido(negro de platino) es el catalizador activo.45 La hidrogenación se lleva a cabo mediante una adición syncuando se utiliza en un alquino, dando como producto un alqueno cis. Algunas de las transformaciones más importantes son:
- La hidrogenación de los compuestos nitro a las aminas correspondientes. Los catalizadores de platino son preferidos a los de paladio para evitar hidrogenólisis alternativas. Cuando se efectúa la reducción de nitrocompuestos a aminas, los catalizadores de platino son preferibles a los catalizadores de paladio para minimizar la hidrogenólisis.
-
- R-NO2 + H2 (Adams) → R-NH2
- Reducción de cetonas a alcoholes.
-
- R-CO-R + H2 (Adams) → R-CH(OH)-R
- En las reducciones de los alquenos, se añade un nitrocompuesto (El cual no es atacado en este caso) al catalizador de Adams.
- El catalizador se utiliza también para la hidrogenólisis de ésteres fenílicos del ácido fosfórico, reacción que no ocurre con los catalizadores de paladio. El pH del disolvente afecta de manera significativa el curso de la reacción, y las reacciones de los catalizadores se han mejorado mediante la realización de la reducción en ácido acético puro, o sus diluciones en otros solventes.
Desarrollo[editar]
Antes de desarrollarse el catalizador de Adams, las hidrogenaciones orgánicas se llevaban a cabo utilizando el paladio coloidal, el platino coloidal o negro de platino. Los catalizadores coloidales eran más activos, pero presentaban la dificultad para aislar los productos de la reacción. Esto condujo al uso generalizado del negro de platino.
Medidas de seguridad[editar]
Pocas medidas de precaución son necesarias con el óxido, pero, después de la exposición a H2, el platino negro resultante puede ser pirofórico. Por lo tanto, no debe dejarse secar y toda exposición al oxígeno debe reducirse al mínimo.



No hay comentarios:
Publicar un comentario