ley de Henry fue formulada en 1803 por William Henry. Enuncia que a una temperatura constante, la cantidad de gas disuelta en un líquido es directamente proporcional a la presión parcial que ejerce ese gas sobre el líquido.1 Matemáticamente se formula de la siguiente manera :2
Ci\cdot=
donde:
- es la presión parcial del gas.
- es la concentración del gas (solubilidad).
- es la constante de Henry, que depende de la naturaleza del gas, la temperatura y el líquido.2
Las unidades de la constante que dependen de las unidades elegidas para expresar la concentración y la presión. Un ejemplo de la aplicación de esta ley está dado por las precauciones que deben tomarse al volver a un buzo a la superficie. Al disminuir la presión parcial de los distintos gases, disminuye la solubilidad de los mismos en la sangre, con el consiguiente riesgo de una eventual formación de burbujas. Para evitarlo, esta descompresión debe efectuarse lentamente.
La Ley de Henry nos da la presión de vapor de un soluto en una disolución diluida ideal. Para el disolvente sigue aplicándose la Ley de Raoult. PA=xAP∗A
Sea una disolución diluida ideal que contiene un disolvente A y solutos (1,2...i). Vamos a calcular la presión que ejerce el soluto i en la fase gas.
Una vez alcanzado el equilibrio:
Sustituyendo los potenciales químicos por sus valores
Agrupando términos y aplicando propiedades de logaritmos neperianos
Despejando
Donde KH es la constante de Henry
Solubilidad de gases en líquidos
Para los gases poco solubles en líquidos, la disolución se aproxima a ideal, cumpliendo la Ley de Henry para el soluto. Como puede observarse en la gráfica, cuando la presión es elevada se produce una desviación respecto a Henry, debido a que la disolución deja de comportarse como diluida ideal.
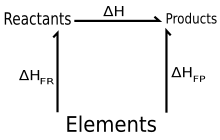
En termodinámica, la ley de Hess, propuesta por Germain Henri Hessen 1840, establece que: «si una serie de reactivos reaccionan para dar una serie de productos, el calor de reacción liberado o absorbido es independiente de si la reacción se lleva a cabo en una, dos o más etapas», esto es, que los cambios de entalpía son aditivos: ΔHneta = ΣΔHr.
Equivalentemente, se puede decir que el calor de reacción sólo depende de los reactivos y los productos, o que el calor de reacción es una función de estado; en este sentido la ley de Hess es la aplicación a las reacciones químicas del primer principio de la termodinámica; debido a que fue enunciada unos diez años antes que ésta, conserva su nombre histórico.1 El propósito de este planteamiento es analizar de forma muy breve las bases de la Termoquímica como una solución a problemas de transferencia de calor en dichos procesos.
Cuando se busca saber qué tanto calor como una forma de la energía absorbida o desprendida está presente en una reacción, es porque la misma juega un papel muy importante de los cambios químicos, la pregunta obvia en este caso resulta; ¿A qué se debe esa importancia? Se debe a que en todo cambio químico hay ruptura y formación de nuevos enlaces químicos y para que haya esa ruptura, se requiere energía y algunas veces en la formación de los nuevos enlaces se requiere de menor energía para su formación y por tanto se desprende la energía sobrante, razón por la cual, el estudio del calor y de su relación con los cambios químicos resulta tan importante. Además de lo anterior es necesario también conocer si el proceso depende no solo de si el cambio se efectúa a volumen o presión constante, sino también de las cantidades de sustancia considerada, su estado físico, temperatura y presión.
En virtud de que la cantidad de calor obtenida en una reacción depende de la cantidad de sustancia que intervino en ella, si escribimos que dos gramos de hidrógeno se queman en oxígeno para producir agua líquida, y se desprenden 68,320 calorías, entonces cuando incrementamos a cuatro gramos, el calor desprendido es doble y así sucesivamente. Esto es, que en vez de especificar la cantidad producido por gramo de sustancia para una reacción particular, es usual hacerlo de la siguiente manera:
- H2 + 1/2 O2 D H2O ∆H = - 68,320 cal
Por ejemplo, el carbono en forma de grafito puede oxidarse hasta dióxido (1) o monóxido (2) de carbono, por otro lado, el monóxido de carbono puede oxidarse hasta dióxido (3). Como se ve a continuación, la suma de las entalpías de la reacción en dos pasos (2)+(3) es igual a la entalpía de la reacción en un paso (1):
Aplicaciones[editar]
La ley de Hess se utiliza para deducir el cambio de entalpía en una reacción ΔHr, si se puede escribir esta reacción como un paso intermedio de una reacción más compleja, siempre que se conozcan los cambios de entalpía de la reacción global y de otros pasos.2 En este procedimiento, la suma de ecuaciones químicasparciales lleva a la ecuación de la reacción global. Si la energía se incluye para cada ecuación y es sumada, el resultado será la energía para la ecuación global. Este procedimiento se apoya en que ya han sido tabuladas los calores de reacción para un gran número de reacciones, incluyendo la formación a partir de sus elementos constituyentes de buena parte de las sustancias químicas conocidas.1 Un caso relevante de este tipo de aplicación es el llamado ciclo de Born-Haber.
La Ley de Hess, es un método indirecto de calcular el Calor de Reacción ó Entalpia de Reacción.
La ley de Hess se puede enunciar como sigue:cuando los reactivos se convierten a productos, el cambio de entalpía es el mismo, independientemente de que la reacción se efectúe en una paso o en una serie de pasos.
En el ejemplo siguiente veremos la aplicación de la Ley de Hess.
Se quiere calcular la Entapía de reacción para la reacción:
2 C(s) + H2(g) → C2H2(g)
Nos proporcionan los datos siguientes:
Planteamos las ecuaciones correspondientes a las entalpías dadas:
Ubicamos en ellas a los reactantes y productos de la reacción química que buscamos:
Ahora debemos acomodar las ecuaciones:
- la ecuación (1) la debemos invertir (recuerden que también se invierte el valor de la entalpía)
- la ecuación (2), debemos multiplicarla por 2 (recuerden se multiplica toda la ecuación, tanto reactantes como productos y el valor de la entalpía, pues es propiedad extensiva.
- la ecuación (3), la dejamos igual.
La sumatoria de las ecuaciones acomodadas debe darnos la ecuación problema.
- Se suman o se anulan los reactantes y productos.
- Las entalpías se suman algebraicamente.
Basandonos en la Ley de Hess, hemos podido encontrar el:
La Ley de Hess basa su principio en que la variación de la entalpía es una función de estado.
Por lo tanto,
es independiente del número de pasos y de la naturaleza específica de cada uno de ellos.
| Problema | |
Jorge ha encontrado en Internet que se puede producir gas etano, C2H6, a partir de hidrógeno gaseoso,H2, y monóxido de carbono, CO, con producción adicional de gas oxígeno O2. Aplicando la Ley de Hess, encuentra el calor de reacción para la producción de etano. Emplea para ello las reacciones que se te dan a continuación:
Señala además si ¿la reacción propuesta en Internet será endotérmica o exotérmica?
|
Calor de Disolución y de Dilución
Hasta ahora hemos centrado el cálculo del calor de reacción como producto de las reacciones químicas, pero muchos proceso físicos, como la fusión del hielo o la condensación de un vapor, también implican la abosrción o desprendiemiento de calor.
También hay cambios de entalpía cuando un soluto se disuleve en un disolvente, o cuando se diluye una disolución.
Veremos ahora estos dos procesos físicos relacionados, que implican al calor de disolución y al calor de dilución.
Para ello debemos definir primero algunos conceptos, entre ellos la Energía Reticular.
Energía Reticular
La formación de compuestos iónicos depende de los valores de las energías de ionización y de la afinidad electrónica de los elementos, estos valores ayudan a predecir cuáles elementos son los más adecuados para formar compuestos iónicos, pero, ¿cómo se puede evaluar la estabilidad de un compuesto iónico? Tanto la energía de ionización, como la afinidad electrónica están definidas por procesos que se llevan a cabo en la fase gaseosa. A 1 atmósfera y 25ºC todos los compuestos iónicos son sólidos.
Una medida de la estabilidad de cualquier sólido iónico es su energía reticular, U, que se define como la energía requerida para separar completamente un mol de un compuesto iónico sólido en sus iones al estado gaseoso.
NaCl(s) → Na+(g) + Cl- (g)
Los valores de Energía reticular (U) serán siempre positivos, pues es la energía suministrada para que se produzcan la disociación del compuesto ionico.
La energía reticular no se puede medir directamente, pero se puede calcular de manera indirecta, si se considera que la formación de un compuesto iónico se efectúa en una serie de pasos conocidos como ciclo de Born -Haber. El ciclo de Born-Haber relaciona las energías de ionización, afinidad electrónica, calor de sublimación, energías de enlace y otras propiedades atómicas y moleculares.
Si queremos encontrar la energía reticular del compuesto iónico LiF(s), y disponemos de los datos siguientes:
Si queremos encontrar la energía reticular del compuesto iónico LiF(s), y disponemos de los datos siguientes:
Debemos:
1. Plantear la ecuación problema.
LiF(s) → Li+(g) + F-(g)
2. Localizar reactantes y productos de nuestra ecuación problema en las ecuaciones dadas.
- Reactantes en la (5)
- Productos en la (3) y (4)
3. Analizar todas las demás ecuaciones, ubicar cuál o cuáles debemos tomar directamente y cuál o cuáles de forma inversa y si alguna necesita multiplicarse por un factor, de tal manera que al aplicar la ley de Hess, se obtenga la ecuación problema.
4. Recordar que la entalpía es una propiedad extensiva, por lo tanto, si se considera una reacción inversa, la energía debe cambiar de signo, y si se multiplica por algún factor, también afectará el valor de la energía.
5. Tomando en cuenta las consideraciones anteriores al aplicar la ley de Hess, tendremos lo siguiente:
4. Recordar que la entalpía es una propiedad extensiva, por lo tanto, si se considera una reacción inversa, la energía debe cambiar de signo, y si se multiplica por algún factor, también afectará el valor de la energía.
5. Tomando en cuenta las consideraciones anteriores al aplicar la ley de Hess, tendremos lo siguiente:
- La ecuación 5 se tomará de forma inversa;
- Las ecuaciones 3, 4 y 1 se tomaran de forma directa; y
- La ecuación 2 deberá multiplicarse por ½
De tal manera que:
Energía Reticular:
Energía Reticular:
Tal como ya hemos mencionado los valores de energía reticular siempre serán positivos, dado que debemos proporcionar energía al sistema.
Sus valores nos proporcionan una información sobre la estabilidad del enlace, tal como se puede apreciar en la tabla anexa sobre valores de energía reticular vs. puntos de fusión.
http://corinto.pucp.edu.pe/quimicageneral/contenido/143-calculo-del-calor-de-reaccion-ley-de-hess.html





No hay comentarios:
Publicar un comentario