método de Ponchon-Savarit es un método gráfico que se emplea en química para calcular el número de platos en una columna de destilación fraccionada binaria.1 Se considera como un método gráfico riguroso debido al uso de las entalpía para la construcción de sus diagramas de equilibrio.
método Dumas, en química analítica, es un proceso de análisis químico para determinar el contenido en nitrógeno de una sustancia química. Se basa en un método inicialmente descrito por Jean-Baptiste Dumas en 1826.1k
Se usa comúnmente para estimar el contenido de proteínas de los alimentos. Los otros componentes mayoritarios como grasas y carbohidratos y otros compuestos estructurales como la lignina no contienen nitrógeno, pero los aminoácidos de las proteínas si. Otras sustancias como las vitaminas también contienen nitrógeno, pero son una parte muy pequeña y tienen una influecia insignificante en el resultado del análisis.
Sin embargo, este método puede ser engañado con otras sustancias nitrogenadas como el NNP, e incluso con sustancias tóxicas y sin ningún valor nutritivo como paso en china en 2008
Otro método para medir el contenido de nitrógeno es método Kjeldahl.
método Hückel, propuesto en 1930 por el físico químico alemán Erich Hückel (1896-1980) , es el método de aproximación más simple de la teoría de orbitales moleculares. Su aplicación está restringida al tratamiento de sistemas de hidrocarburos planos con enlaces π conjugados como, por ejemplo, etano (etilo), benceno, butadieno, etc. Sólo es aplicable al estudio de aquellas propiedades que estén dominadas por los orbitales moleculares π. Asimismo, es la base teórica de la regla de Hückel.
Aunque inicialmente sólo trataba sistemas formados en su totalidad por átomos de carbono, más tarde se extendió su uso a otras sustancias como la piridina, el pirrol y el furano, moléculas en cuya composición se encuentran átomos de nitrógeno y oxígeno, entre otros. Son los denominados heteroátomos.
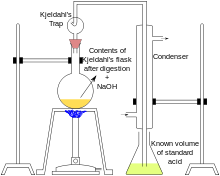
método Kjeldahl o digestión de Kjeldahl, en química analítica, es un proceso de análisis químico para determinar el contenido en nitrógeno de una sustancia química y se engloba en la categoría de medios por digestión húmeda. Se usa comúnmente para estimar el contenido de proteínas de los alimentos. Fue desarrollado por el danés Johan Kjeldahl en 1883.12
Otro método para medir el contenido de nitrógeno es método Dumas.
Etapas del método Kjeldahl[editar]
El método desarrollado por Kjeldahl consta de tres etapas:
Digestión[editar]
- 1.ª Digestión: conversión del Nitrógeno (proveniente de las proteínas) en ion amonio mediante calentamiento a una temperatura de 400º C aproximadamente, en bloque de digestión con adición previa de ácido sulfúrico y catalizador (sulfato de cobre (II), Hg elemental), que desencadenan la conversión del nitrógeno de la muestra en amonio.
Destilación[editar]
- 2.ª Destilación: separación por arrastre con vapor del amoníaco y posterior solubilización en una solución ácida de concentración conocida.
- En esta etapa se adiciona NaOH a la disolución de amonio obtenida previamente, generándose NH3 y vapor de agua, que arrastra al mismo.
- La solubilización posterior en la solución ácida permite la conversión de NH3 a catión amonio, el cual se encuentra junto con el exceso de solución ácida añadido.
- El NH3 puede recogerse sobre dos medios: ácido fuerte en exceso de concentración conocida, o bien, ácido bórico en exceso medido.
Valoración[editar]
- 3.ª Valoración: medición de la cantidad de ácido neutralizado por el amoníaco disuelto, lo que indica la cantidad de Nitrógeno presente en la muestra inicial.
Según el medio de recogida en la destilación, el amonio se valora de dos formas:
- recogida sobre ácido fuerte en exceso medido: se emplea una base y el indicador rojo metilo, por ejemplo;
- recogida sobre ácido bórico en exceso medido: se emplea un ácido y el indicador rojo metilo, por ejemplo.
modelo atómico de Dalton1 fue el primer modeloatómico con bases científicas, propuesto entre 1803 y 1807 por John Dalton,2 aunque el autor lo denominó más propiamente "teoría atómica" o "postulados atómicos".
El modelo permitió aclarar por primera vez el por qué las sustancias químicas reaccionaban en proporciones estequiométricas fijas (Ley de las proporciones constantes), y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros (Ley de las proporciones múltiples).3 Por ejemplo 12 g de carbono (C), pueden reaccionar con 16 g de oxígeno (O2) para formar monóxido de carbono (CO) o pueden reaccionar con 32 g de oxígeno para formar dióxido de carbono (CO2).
Además el modelo aclaraba que aún existiendo una gran variedad de sustancias diferentes, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos.
En esencia, el modelo explicaba la mayor parte de la química de fines del siglo XVIII y principios del siglo XIX, reduciendo una serie de hechos complejos a una teoría combinatoria realmente simple.
Postulados de Dalton[editar]
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa e iguales propiedades. Los átomos de diferentes elementos tienen masa diferente. Comparando la masa de los elementos con los del hidrógeno tomado como la unidad, propuso el concepto de peso atómico relativo.
- Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos, guardan relaciones simples de números enteros y pequeños.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos.
La materia está formada por partículas muy pequeñas llamadas “átomos”. Estos átomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y nunca cambian.
Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y dimensiones. Por ejemplo: todos los átomos de hidrógeno son iguales.
Por otro lado, los átomos de elementos diferentes son diferentes. Por ejemplo: los átomos de oxígeno son diferentes a los átomos de hidrógeno.
Los átomos pueden combinarse para formar compuestos químicos. Por ejemplo: los átomos de hidrógeno y oxígeno pueden combinarse y formar moléculas de agua.
Los átomos se combinan para formar compuestos en relaciones numéricas simples. Por ejemplo: al formarse agua, la relación es de 2 a 1 (dos átomos de hidrógeno con un átomo de oxígeno).
Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto. Por ejemplo: un átomo de carbono con uno de oxígeno forman monóxido de carbono (CO), mientras que dos átomos de oxígeno con uno de carbono, forman dióxido de carbono (CO2).
Insuficiencias del modelo[editar]
La hipótesis de John Dalton, que afirmaba que los elementos en estado gaseoso eran monoatómicos y que los átomos de los elementos se combinaban en la menor proporción posible para formar átomos de los compuestos, lo que hoy llamamos moléculas, generó algunas dificultades. Por ejemplo, Dalton pensó que la fórmula del aguaera HO.5 En consecuencia de esto se realizaron cálculos erróneos sobre la masa y peso de algunos compuestos básicos.
En 1805, Gay-Lussac y Alexander von Humboldt mostraron que el agua estaba formada por dos átomos de hidrógeno y uno de oxígeno.6 En 1811, Amedeo Avogadro concretó la exacta composición del agua,7 basándose en lo que hoy se conoce como Ley de Avogadro y la evidencia de la existencia de moléculas diatómicas homonucleares. No obstante, estos resultados fueron ignorados en su mayor parte hasta 1860. Esto fue, en parte, por la creencia de que los átomos de un elemento no tenían ninguna afinidad química hacia átomos del mismo elemento. Además, algunos conceptos de la disociación de moléculas no estaban explicados en la Ley de Avogadro.
En 1860, en el Congreso de Karlsruhe sobre masas estables y pesos atómicos, Cannizzaro revivió las ideas de Avogadro y las usó para realizar una tabla periódica de pesos atómicos,8 que tenían bastante similitud con los actuales valores. Estos pesos fueron un importante prerrequisito para el descubrimiento de la Tabla periódica de Dmitri Mendeléyev y Lothar Meyer.
Hasta la segunda mitad del siglo XIX no aparecieron evidencias de que los átomos fueran divisibles o estuvieran a su vez constituidos por partes más elementales.9 Por esa razón el modelo de Dalton no fue cuestionado durante décadas, ya que explicaba adecuadamente los hechos. Si bien el modelo usualmente nacido para explicar los compuestos químicos y las regularidades estequiométricas, no podía explicar las regularidades periódicas en las propiedades de los elementos químicos tal como aparecieron en la tabla periódica de los elementos de Mendeleiev (esto solo sería explicado por los modelos que suponían que el átomo estaba formado por electrones dispuestos en capas). El modelo de Dalton tampoco podía dar cuenta de las investigaciones realizadas sobre rayos catódicos que sugirieron que los átomos no eran indivisibles pero que contenían partículas más pequeñas cargadas eléctricamente.
modelo de Dewar-Chatt-Duncanson es un modelo en química organometálica que explica el tipo de enlace químico entre un alqueno y un metal (complejo π) en ciertos compuestos organometálicos. El nombre del modelo es en honor a Michael J. S. Dewar,1 Joseph Chatt y L. A. Duncanson.23
El alqueno ácido π dona densidad electrónica en un orbital d del metal a partir de la simetría π del orbital enlazante entre los átomos de carbono (I). El metal retrodona electrones a partir de un orbital d lleno diferente al orbital antienlazante π* (II). Ambos efectos tienden a reducir el orden de enlace carbono-carbono, conduciendo a una distancia C-C elongada y la disminución de su frecuencia vibracional.
En la sal de Zeise, K[PtCl3C2H4)].H2O, la longitud de enlace C-C ha aumentado a 134 pm de los 133 pm en el etileno. En el compuesto de níquel Ni(CH2CH2)(PPh3)2, el valor es 143 pm.
La interacción también ocasiona que los átomos de carbono se "rehibridicen", de sp2 a sp3, lo que está indicado por la flexión de los átomos de hidrógeno en el etileno en dirección opuesta al metal.4 Los cálculos in silicomuestran que el 75% de la energía de enlace se debe a la donación directa, y el 25% a la retrodonación.5 Este modelo es una manifestación específica del modelo más general de retrodonación π.


No hay comentarios:
Publicar un comentario