En bioquímica, el diagrama de Lineweaver-Burk se emplea como herramienta gráfica para calcular los parámetros cinéticos de una enzima.
Su utilidad consiste en que el recíproco de la cinética de Michaelis-Menten es fácilmente representable y que de él emanan mucha información de interés.
Cuyo recíproco es:
donde V es la velocidad de reacción, Km es la constante de Michaelis-Menten, Vmax es la velocidad máxima, y [S] es la concentración de sustrato.
La representación gráfica de Lineweaver-Burk permite identificar el Km y Vmax; el punto de corte con el eje de ordenadas es el equivalente a la inversa de Vmax, y el de abscisas es el valor de -1/Km.
Inconvenientes del método[editar]
- Como requiere de dobles inversos, pequeños errores experimentales pueden conducir a grandes errores.
- A altas concentraciones los puntos se aglutinan al principio de la gráfica.
En química, un diagrama de Pourbaix traza un equilibrio estable en las fases de un sistema electroquímico acuoso. Los límites de iones predominantes son representados por líneas. Como tal, la comprensión de un diagrama de Pourbaix es similar a la de un diagrama de fases. El diagrama tienen el nombre de Marcel Pourbaix, químico belga que lo creó en 1938.
Los diagramas de Pourbaix también son conocidos como los diagramas de Eh-pH, debido a la rotulación de los dos ejes. El eje vertical se denomina Eh para el potencial de voltaje con respecto al electrodo estándar de hidrógeno(SHE), calculada por la ecuación de Nernst. La "h" significa hidrógeno, aunque normalmante se pueden utilizar otros elementos.
El eje horizontal es la etiqueta de pH para el registro de función de la concentración de iones del hidrógeno.
Las líneas de los iones se dibujan en una unidad (alrededor de 1 M) y representan el equilibrio de la concentración. Las líneas adicionales se pueden sacar para otras concentraciones, por ejemplo, 10-3 M o 10-6 M
Si bien estos diagramas se pueden extraer de cualquier sistema químico, es importante señalar que la adición de un agente de unión de metal (ligando) a menudo se modificará el esquema. Por ejemplo, el carbonatotiene un gran efecto sobre el diagrama de uranio.
Además, la temperatura y la concentración de iones en disolución solvatada cambiará las líneas de equilibrio de acuerdo con la ecuación de Nernst.
Un diagrama simplificado de Pourbaix indica las regiones de "inmunidad", "corrosión" y "pasividad", en lugar de las especies estables. De este modo, dará una guía para la estabilidad de un metal en un entorno específico. Inmunidad significa que el metal no es atacado, mientras que muestra la corrosión que se produce el ataque general. Pasivación se produce cuando el metal forma una capa estable de un óxido u otra sal en su superficie, el mejor ejemplo es la relativa estabilidad de aluminio debido a la capa de alúmina formada en su superficie cuando se expone al aire.
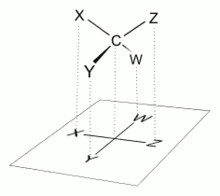
La proyección de Fischer, ideada por el químico alemán Hermann Emil Fischer en 1891,1 es una proyección bidimensional utilizada en química orgánica para representar la disposición espacial de moléculas en las que uno o más átomos de carbono están unidos a 4 sustituyentesdiferentes.
Estos átomos pueden existir en dos configuraciones espacialmente diferentes, que son imágenes especulares (simétricas respecto a un plano) entre sí, como lo son la mano derecha de la izquierda, y al igual que éstas no son superponibles en el espacio.
Estos átomos constituyen centros quirales o de isomería espacial. Cada centro quiral da lugar a dos moléculas isómeras especulares o enantiómeros. Una molécula con 2 centros quirales puede tener 4 estereoisómeros (22 esteroisómeros, 2 parejas de enantiómeros); una con 3 centros quirales puede tener 8 estereoisómeros (23esteroisómeros, 4 parejas de enantiómeros); y así sucesivamente.
Los estereoisómeros que posibilitan los centros quirales de una molécula son, en principio, iguales química y físicamente, salvo que al incidir sobre sus respectivas disoluciones la luz polarizada el plano de vibración de ésta gira un ángulo diferente en cada caso.
En una proyección de Fischer se representa cada carbono quiral con sus cuatro sustituyentes dispuestos en cruz aplicando la siguiente convención:
- Los sustituyentes situados a derecha e izquierda sobresalen del plano de representación (papel o pantalla) y en el espacio estarían situados por delante de dicho plano, hacia el observador.
- Los sustituyentes representados arriba y debajo del centro quiral estarían situados espacialmente detrás del átomo quiral.
Hay que cuidar de no girar 90º la proyección de una molécula dada, porque obtendremos la representación de su enantiómero: los sustituyentes que en la primera estaban dirigidos "hacia el fondo" habrán pasado a estarlo "hacia adelante" y viceversa.
Ejemplos[editar]
- 1º) Operación "no permitida": Las dos proyecciones siguientes, aunque no lo parezca, representan a estereoisómeros sin imagen especular(diasteromeros) y no a la misma molécula como pudiera creerse:
OH NH2
| |
H2N - C -H Giro de 90º hacia la derecha: F - C - OH
| |
F H
- 2º) Operación "permitida": Si aplicamos un plano de simetría -vertical u horizontal- a la proyección de una molécula obtendremos la proyección de su isómero especular; en este caso la de la molécula de la fotografía:
OH
|
H2N - C - H
|
F
–––––––––––––––––– Plano de simetría
F
|
H2N - C - H
|
OH
La primera fórmula representa el isómero que aparece en el espejo de la fotografía de la derecha y la segunda el que se halla sobre la mesa. En dicha fotografía se utilizan los siguientes colores para cada grupo funcional o sustituyente:
- Azul: NH2
- Gris: H
- Rojo: OH
- Verde: F
- Negro: C
Para situar la imagen del espejo en la posición que indica la 1ª proyección hay que girar mentalmente la molécula alrededor del átomo central moviendo la bola roja "hacia el fondo" y la verde hacia abajo y adelante, de modo que la roja la negra y la verde queden en el mismo plano vertical, y que la azul y la gris se "levanten" hasta formar un plano horizontal junto a la negra.
Para hacer lo mismo con el modelo que hay sobre la mesa hasta la posición indicada en la 2ª proyección: Hay que voltear la molécula "bajando" las bolas azul y gris situándolas, junto a la negra, en un plano horizontal pero "por delante" de ésta. Las bolas verde y roja quedarían, junto a la negra, en un plano vertical pero "por detrás" de ésta: la verde encima y la roja debajo, como en la proyección.

![{\displaystyle V=V_{max}{\frac {[S]}{K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16e858174569d133bc08e9c5ada05212d88a418f)
![{\displaystyle {1 \over V}={(K_{m}+[S]) \over (V_{max}[S])}={K_{m} \over V_{max}}{1 \over [S]}+{1 \over V_{max}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/696639019ef0572ec2042e7e259b3fa61900767d)

![{\displaystyle Eh=E^{0}-{\frac {0.0592}{n}}\log {\frac {[C]^{c}[D]^{d}}{[A]^{a}[B]^{b}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f07eb7a241b75c38e6d900f646ec9b13775b16ac)
![{\displaystyle \mathrm {pH} =-\log[H^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/707f2b936181f3b7ccccf8ae7a148f6f58492c15)



No hay comentarios:
Publicar un comentario