regla de Abegg establece que la diferencia entre el máximo y mínimo número de oxidación de un elemento químico es frecuentemente ocho. En general, para un elemento químico dado (como el azufre), la regla de Abegg establece que la suma de los valores absolutos de su mínimo número de oxidación (de -2 para el azufre en H2S) y su máximo número de oxidación (de +6 para el azufre en H2SO4) es frecuentemente igual a 8. Esta regla fue formulada en 1904 por el químico alemán Richard Abegg. Se usó como base para el argumento del artículo de Gilbert N. Lewis de 1916 «The Atom and the Molecule» (El átomo y la molécula),1 artículo que posteriormente inspiró a Linus Pauling a escribir el libro de texto The Nature of the Chemical Bond (La naturaleza del enlace químico). Lewis usó esta regla para desarrollar su modelo del átomo cúbico, que posteriormente desarrolló en su regla del octeto. La regla de Abegg también es conocida como la "ley de Abegg de la valencia y contravalencia".
El modelo atómico de Schrödinger permitió explicar la regla de Abegg, ya que muchos enlaces químicos covalentes se dan entre elementos cuyos dos últimos orbitales son un orbital de tipo s y tres orbitales de tipo p(dado que cada uno de estos orbitales puede contener como mucho dos electrones, la regla de Abegg está relacionada con las diferentes maneras de distribuir electrones el máximo número posible de electrones entre los diferentes orbitales moleculares posibles.
regla de Baird relaciona la aromaticidad con el número de electrones deslocalizados en orbitales sp2 de una molécula orgánica plana y cíclica un estado triplete que tiene enlaces simples y enlaces dobles conjugados. En concreto, la regla de Hückel indica que una molécula plana un estado triplete es aromática si tiene 4n electrones π.
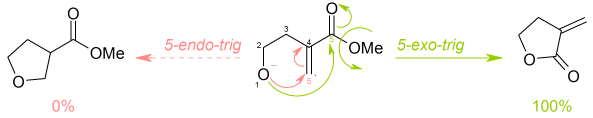
reglas de Baldwin son un conjunto de lineamientos que delínean los favoritismos relativos de las reacciones de cierre de anillos en los compuestos alicíclicos. Fueron propuestas por primera vez por Jack Baldwin en 1976.12
Las reglas clasifican los cierres de anillo en tres formas:
- el número de átomos en nuevos anillos formados
- en cierres de anillo exo y endo, dependiendo de si el enlace roto durante el cierre del anillo está adentro (endo) o afuera (exo) del anillo que se forma
- en tet, trig y dig, dependiendo de si el carbono electrofílico es tetraédrico/sp3 (tet), trigonal/sp2, (trig) o digonal/sp, (dig)
En consecuencia, una reacción de cierre de anillo podría ser clasificada como, por ejemplo, una 5-exo-trig.
Baldwin descubrió que los requerimientos de traslape de orbitales para la formación de enlaces favorecen sólo ciertas combinaciones de tamaño de anillo y de los parámetros exo/endo/dig/trig/tet.
Existen algunas excepciones para las reglas de Baldwin. Por ejemplo, frecuentemente los cationes desobedecen las reglas de Baldwin, así como las reacciones en que está incluido en el anillo un átomo de la segunda fila. Otra excepción importante es para la ciclación 5-endo-trig, está favorecida para elementos del 2º periodo.
| Cierres de anillo des/favorecidos según Baldwin | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 4 | 5 | 6 | 7 | ||||||
| tipo | exo | end | exo | end | exo | end | exo | end | exo | end |
| tet | √ | √ | √ | X | √ | X | √ | |||
| trig | √ | X | √ | X | √ | X | √ | √ | √ | √ |
| dig | X | √ | X | √ | √ | √ | √ | √ | √ | √ |
Las reglas se aplican cuando el nucleófilo puede atacar al enlace en cuestión en un ángulo ideal. Estos ángulos son 180° para las reacciones exo-tet, 109° para las reacciones exo-trig, y 120° para las reacciones endo-dig.
Aplicaciones[editar]
En un estudio, se construyeron anillos de siete miembros en una reacción de adición tándem 5-exo-dig, del tipo rearreglo de Claisen:3
Se observó un patrón 6-endo-dig en una adición 1,2 tándem aleno - alquino del tipo ciclización de Nazarov, catalizada por un compuesto de oro:4
Una reacción de cierre de anillo 5-endo-dig tomó parte de una síntesis de la (+)-Preusina5
Las reglas de Baldwin también se aplican a las ciclizaciones aldólicas que involucran a enolatos:67
Las reglas son las siguientes:8
| Cierres de anillo des/favorecidos para enolatos | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| enolendo | enolexo | |||||||||
| tipo | 3 | 4 | 5 | 6 | 7 | 3 | 4 | 5 | 6 | 7 |
| exo-tet | X | X | X | √ | √ | √ | √ | √ | √ | √ |
| exo-trig | X | X | X | √ | √ | √ | √ | √ | √ | √ |

regla de Bent concierne a la hibridación de orbitales, y fue enunciada en 1961 por el químico americano Henry Bent.1 Originalmente, la regla de Bent fue expresada como sigue:
- El carácter atómico s se concentra en orbitales dirigidos hacia sustituyentes electropositivos.
En otras palabras, en términos más inteligibles, como función del carácter p de los orbitales híbridos:
- Un átomo central tiende a dirigir sus híbridos de mayor carácter p hacia los sustituyentes más electronegativos.





No hay comentarios:
Publicar un comentario