La estructura de Lewis, también llamada diagrama de punto y raya diagonal, modelo de Lewis, representación de Lewis o fórmula de Lewis, es una representación gráfica que muestra los pares de electrones de enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir. Son representaciones adecuadas y sencillas de iones y compuestos, que facilitan el recuento exacto de electrones y constituyen una base importante, estable y relativa. Esta representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros o entre su misma especie, formando enlaces ya sea simples, dobles, o triples y después de cada uno de estos se encuentran en cada enlace covalente.
Las estructuras de Lewis muestran los diferentes átomos de una determinada causa usando su símbolo químico y líneas que se trazan entre los átomos que se unen entre sí. Representan también si entre los átomos existen enlaces simples, dobles o triples. En ocasiones, para representar cada enlace, se usan pares de puntos en vez de líneas. Los electrones apartados (los que no participan en los enlaces) se representan mediante una línea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece.
Este modelo fue propuesto por Gilbert Newton Lewis quién lo introdujo por primera vez en 1916 en su artículo La molécula y el átomo.
Moléculas[editar]
Véase también: Electronegatividad
Las moléculas más simples, entre las cuales se encuentran las moléculas orgánicas, deben presentar un átomo central, en algunos casos el átomo central es el carbono debido a que es el elemento más electropositivo, luego éste queda rodeado por los demás átomos de las otras moléculas. En moléculas compuestas por varios átomos de un mismo elemento y un átomo de otro elemento distinto, este último se utiliza como el átomo central, lo cual se representa en el diagrama con 4 átomos de hidrógeno y uno de silicio. El hidrógeno también es un elemento exceptuante, puesto que no debe ir como átomo central.
En algunos casos es difícil determinar el átomo central, en general cuando todos los átomos de los elementos del compuesto aparecen más de una o dos veces.
Electrones de Valencia[editar]
El número total de electrones representados en un diagrama de Lewis es igual a la suma de los electrones de valencia de cada átomo. La valencia que se toma como referencia y que se representa en el diagrama es la cantidad de electrones que se encuentran en el último nivel de energía de cada elemento al hacer su configuración electrónica.
Cuando los electrones de valencia han sido determinados, deben ubicarse en el modelo a estructurar.
Una vez que todos los pares solitarios han sido ubicados, los átomos, especialmente los centrales, pueden no tener un octeto de electrones. Los átomos entre sí deben quedar unidos por enlaces; un par de electrones forma un enlace entre los dos átomos. Así como el par del enlace es compartido entre los dos átomos, el átomo que originalmente tenía el par solitario sigue teniendo un octeto; y el otro átomo ahora tiene dos electrones más en su última capa.
Fuera de los compuestos orgánicos, solo un porcentaje menor de los compuestos tiene un octeto de electrones en su última capa. Compuestos con más de ocho electrones en la representación de la estructura de Lewis de la última capa del átomo, son llamados hipervalentes, y son comunes en los elementos de los grupos 15 al 18, tales como el fósforo, azufre, yodo y xenón.
Cuando se escribe la estructura de Lewis de un ion, la estructura entera es ubicada entre corchetes, y la carga se escribe como un exponente en el rincón derecho superior, fuera de los corchetes.
La regla del octeto[editar]
La regla del octeto, establece que los átomos se enlazan unos a otros en el intento de completar su capa de valencia (última capa de la electrosfera). La denominación “regla del octeto” surgió en razón de la cantidad establecida de electrones para la estabilidad de un elemento, es decir, el átomo queda estable cuando presenta en su capa de valencia 8 electrones. Para alcanzar tal estabilidad sugerida por la regla del octeto, cada elemento precisa ganar o perder (compartir) electrones en los enlaces químicos, de esa forma ellos adquieren ocho electrones en la capa de valencia. Veamos que los átomos de oxígeno se enlazan para alcanzar la estabilidad sugerida por la regla del octeto. La justificativa para esta regla es que las moléculas o iones, tienden a ser más estables cuando la capa de electrones externa de cada uno de sus átomos está llena con ocho electrones (configuración de un gas noble). Es por ello que los elementos tienden siempre a formar enlaces en la búsqueda de tal estabilidad.
Los átomos son más estables cuando consiguen ocho electrones en la capa de su estado de óxido, sean pares solitarios o compartidos mediante enlaces covalentes. Considerando que cada enlace covalente simple aporta dos electrones a cada átomo de la unión, al dibujar un diagrama o estructura de Lewis, hay que evitar asignar más de ocho electrones a cada átomo.
Excepciones a la regla del Octeto[editar]
El hidrógeno tiene un sólo orbital en su capa de valencia la cual puede aceptar como máximo dos electrones.
El berilio que se completa con una cantidad de cuatro electrones.
El boro que requiere de seis electrones para llevar a cabo esta función.
Por otra parte, los átomos no metálicos a partir del tercer período pueden formar "octetos expandidos" es decir, pueden contener más que ocho electrones en su capa de valencia, por lo general colocando los electrones extra en subniveles.
Carga formal[editar]
En términos de las estructuras de Lewis en general, la carga formal de un átomo puede ser calculada usando la siguiente fórmula, las definiciones no estándar asumidas para el margen de beneficio utilizaron:
- .
Donde:
- Cf es la carga formal.
- Nv representa el número de electrones de valencia en un átomo libre.
- Ue representa el número de electrones no enlazados.
- Bn representa el número total de electrones de enlace, esto dividido entre dos.
La carga formal del átomo es calculada como la diferencia de carga eléctrica entre los electrones de valencia de un átomo aislado y el número de electrones asignados a ese átomo en la estructura de Lewis. El total de las cargas formales en una molécula neutra debe ser igual a cero.
Ejemplo: Estructura de Lewis para el ion nitrito[editar]
La fórmula del ion de nitrito es NO2-
- Paso uno: Escoger el átomo central. Existe sólo un átomo de nitrógeno, y es el átomo con mas electronegatividad, por lo que éste se convertirá en nuestro átomo central.
- Paso dos: Contar los electrones de valencia. El nitrógeno posee 5 electrones de valencia; cada oxígeno posee 6, para un total de (6 × 2) + 5 = 17. El ion posee una carga de –1, lo que nos indica un electrón extra, por lo que el número total de electrones es de 18.
- Paso tres: Ubicar los pares electrónicos. Cada oxígeno debe ser enlazado al nitrógeno, que usa cuatro electrones, dos en cada enlace. Los 14 electrones restantes deben ser ubicados inicialmente como 7 pares solitarios. Cada oxígeno debe tomar un máximo de 3 pares solitarios, dándole a cada oxígeno 8 electrones, incluyendo el par del enlace. El séptimo par solitario debe ser ubicado en el átomo de nitrógeno.
- Paso cuatro: Cumplir la regla del octeto. Ambos átomos de oxígeno poseen 8 electrones asignados a ellos. El átomo de nitrógeno posee sólo 6 electrones asignados. Uno de los pares solitarios de uno de manera simple con el átomo de nitrógeno. Ponga los corchetes alrededor de cada estructura, y escriba la carga ( - ) en el rincón superior derecho afuera de los corchetes. Dibuje una flecha doble entre las dos formas de resonancia.
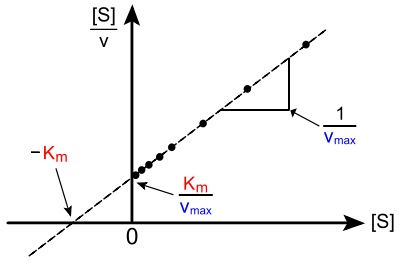
En bioquímica, el diagrama Hanes–Woolfse emplea como herramienta gráfica para calcular los parámetros cinéticos de una enzima. En él se representa la relación concentración de sustrato/velocidad de reacción frente a la concentración de sustrato [S]. Es una de las formas de linealizar la ecuación de Michaelis-Menten.
donde V es la velocidad de reacción, Km es la constante de Michaelis-Menten, Vmax es la velocidad máxima, y [S] es la concentración de sustrato.
La ecuación se puede obtener a partir de la de Michaelis siguiendo los siguientes pasos:
Inviertiendo y multiplicando por [S]:
Reordenando:
La representación gráfica de Hanes permite identificar el Km y Vmax; el punto de corte con el eje de ordenadas es el equivalente a Km/Vmax, y el de abscisas es el valor de −Km.



![{\displaystyle C_{f}=N_{v}-[U_{e}+{\frac {B_{n}}{2}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4baa369f5726d1e0d5691834a9ca248e2468e83)

![{\displaystyle {[S] \over v}={[S] \over V_{\max }}+{K_{m} \over V_{\max }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cfabea4f5fe6b4c2e6533f824b5f15aefc18218)
![{\displaystyle v={{V_{\max[}S]} \over {K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ffe8e1abf595d0f2b2941797aa98e1784cb21452)
![{\displaystyle {[S] \over v}={{[S](K_{m}+[S])} \over {V_{\max[}S]}}={{K_{m}+[S]} \over {V_{\max }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/205ac16a4c5734f25049d68170b38505062b7342)
![{\displaystyle {[S] \over v}={1 \over V_{\max }}[S]+{K_{m} \over V_{\max }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3bb781047fcb26179df1b93d6d8c0cde115a59b4)
No hay comentarios:
Publicar un comentario