constante de Faraday (símbolo F) es utilizada en física y química, y se define como la cantidad de carga eléctrica en un mol de electrones. La constante de Faraday fue nombrada así en honor del científico británicoMichael Faraday. Es utilizada en los sistemas electro químicos para calcular la masa de los elementos que se formarán en un electrodo.
Está representada por el símbolo F, y está dada por la relación:1
donde NA es el número de Avogadro (aproximadamente 6.022×1023 mol-1) y e es la carga eléctrica elemental, o la magnitud de la carga eléctrica de un electrón (aproximadamente 1.602×10−19 coulombios por electrón).
El valor de F fue calculado pesando la cantidad de plata depositada en una reacción electro química en la que una cantidad determinada de corriente fue conducida en un determinado tiempo. Este valor fue luego utilizado para calcular el número de Avogadro. Las investigaciones continúan para determinar una manera más exacta de calcular La constante de Faraday, y por lo tanto el número de Avogadro. Inclusive hay planes de utilizar este valor para re-definir el kilogramo en términos de un número específico de átomos.
constante de Michaelis-Menten (símbolo Km) corresponde a la concentración de sustrato con la cual la velocidad de reacción enzimática alcanza un valor igual a la mitad de la velocidad máxima.
En medios con condiciones definidas de pH y temperatura, la constante tiene un valor fijo para cada enzima y sirve para caracterizarla.
Describe la cinética enzimática de muchas de ellas. Fue nombrada en honor de Leonor Michaelis y de Maud Menten. Este modelo cinético es válido sólo cuando la concentración de enzima es mucho menor que la concentración del sustrato (i.e., la concentración de enzimas es el factor limitante), y cuando la enzima no tiene regulación alostérica.
números de Damköhler (Da) son números adimensionales utilizados en ingeniería química para relacionar la escala temporal de una reacción química con otros fenómenos que ocurran en el sistema. Se llaman así en honor al químico alemán Gerhard Damköhler (1908-1944).
Hay varios números de Damköhler y su definición varía de acuerdo al sistema en consideración. Así para una reacción química A → B de orden n en un sistema batch, el número de Damköhler se define como:
en donde:
- k es la constante cinética de la reacción química.
- C0 es la concentración inicial.
- n es el orden de reacción.
- t es el tiempo.
Aquí el número de Damköhler representa un tiempo de reacción adimensional. En procesos químicos continuos o semibatch, la definición general del número de Damköhler se define como:
O también:
Por ejemplo, en un reactor químico continuo, el número de Damköhler es:
en donde τ es el tiempo de residencia medio.
En sistemas reactivos donde se incluya también el transporte de materia entre fases, el Segundo Número de Damköhler (DaII) se define como la relación entre la velocidad de reacción química y la velocidad de transferencia de masa.
en donde:
- kg es el coeficiente global de transporte de masa.
- a es el área interfacial.
Número de Damköhler en combustión[editar]
El número de Damköhler se utiliza en combustión turbulenta y corresponde a la relación entre la escala de tiempo de la reacción química y la escala de tiempo de la turbulencia . Esta escala de tiempo turbulenta es normalmente una escala de tiempo integral.
El número de Damköhler mide cuán importante es la interacción entre la reacción química y la turbulencia.
Si Da << 1 la turbulencia es mucho más rápida que la reacción química. El número de Karlovitz está relacionado al número de Damköhler, cuando la escala de turbulencia es la escala de Kolmogórov.
El defecto Schottky es típico de los materiales cerámicos, pues es un defecto que aparece para mantener la electroneutralidad del material. Se generan vacantes de iones de signo contrario para anularse de forma estequiométrica; con el fin de mantener una carga total neutra. Cada vacante es un defecto de Schottky por separado.
Es nombrado en reconocimiento del físico alemán de origen suizo Walter H. Schottky (1886-1976).
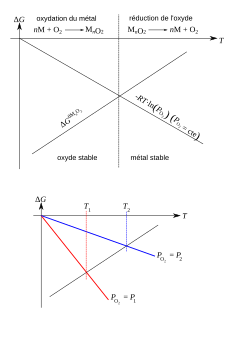
Un diagrama de Ellingham es un diagrama que muestra la dependencia de la estabilidad de los compuestos con la temperatura. Este análisis se utiliza generalmente para evaluar la facilidad de reducción de óxidos y sulfuros de metales. Estos diagramas fueron construidos por primera vez por Harold Ellinghamen 1944.1
En metalurgia, los diagramas de Ellingham se utilizan para predecir la temperatura de equilibrio entre un metal, su óxido y el oxígeno, y, por extensión, las reacciones de un metal con azufre, nitrógeno, y otros elementos no metálicos. Los diagramas son útiles para predecir las condiciones en las que un mineral metálico será reducido al metal.
dihidroxilación asimétrica de Sharpless, también conocida como bishidroxilación, llamada así en honor del químico estadounidense K. Barry Sharpless, es una reacción química enantioselectiva de alquenos con tetróxido de osmio en presencia de un ligando de quinina quiral para formar un diol vecinal.123
Normalmente se produce esta reacción usando cantidades catalíticas de tetróxido de osmio, que después de la reacción es regenerado bien con ferricianina de potasio45 o N-metilmorfolina N-óxido.67 Estas condiciones reducen drásticamente las cantidades necesarias de tetróxido, un compuesto altamente tóxico y oneroso. Los cuatro reactivos son comerciales y se pueden obtener bajo el nombre «AD-mix». La mezcla que contiene (DHQ)2-PHAL se denomina AD-mix-α, mientras que la mezcla que contiene (DHQD)2-PHAL se denomina AD-mix-β.
Mecanismo de la reacción[editar]
El mecanismo de la dihidroxilación asimétrica de Sharpless comienza con la formación del complejo tetróxido de osmio-ligando (2). Una cicloadición [3+2] con el alqueno (3) conduce al intermediario cíclico 4.910 La posterior hidrólisis básica libera el diol (5) y el osmiato reducido (6). Finalmente, el oxidante añadido en cantidades estequiométricas regenera el complejo tetróxido de osmio-ligando (2).
Aplicaciones[editar]
La dihidroxilación clásica, en presencia de un catalizador quiral, necesita osmio.123 La dihidroxilación asimétrica de Sharpless reduce drásticamente el coste de este procedimiento, abriendo el campo de reacciones orgánicas que incluyen osmiatos simpatéticos y biomiméticos.
Ejemplos[editar]
El primer paso en la síntesis del aza-azúcar 6 es una reacción de dihidroxilación11 del dieno proquiral 1. Los aza-azúcares son compuestos de gran importancia farmacológica. Toda la reacción se realiza en medio acuoso y no es necesario añadir grupos protectores. El paso 2 consiste, además, en una sustitución nucleófila del derivado bromado quimioselectiva por parte del hidroxilo.
La dihidroxilación asimétrica de Sharpless es también un paso clave en la síntesis total del taxol de Kuwajima.











No hay comentarios:
Publicar un comentario