catalizadores de Ziegler-Natta son complejos metal con propiedades catalíticas que permiten la polimerización estereoespecífica de alquenos.
Historia[editar]
El proceso fue desarrollado en el grupo de Karl Ziegler en el instituto Max Planck de Mülheim (Max-Planck-Institut für Kohlenforschung). Su primera aplicación era la polimerización de etileno. En el grupo de Giulio Natta se amplió el campo de aplicación al propileno permitiendo un control de la tacticidad del polímero. Ambos químicos fueron galardonados por sus descubrimientos con el premio nobel de química en 1963.
En 2007 la cantidad total de HDPE (polietileno de alta densidad) fabricado con catalizadores Ziegler-Nata superó las 30 mil toneladas. La cantidad de polipropileno era de 45,1 mil toneladas en el mismo año. Además se fabrican con estos catalizadores otros poliolefinos menos comunes como el polibutadieno alto-cis.
Catalizadores clásicos[editar]
Los catalizadores clásicos del tipo Ziegler-Natta son catalizadores mixtos que contienen un compuesto organometálico de los grupos principales I, II o III del sistema periódico (p.ej. trietilaluminio Al(C2H5)3) y un compuesto de un metal de transición (p.ej. tetracloruro de titanio TlCl4). Estos compuestos tienen un carácter de ácido de Lewis. 1
Se puede tratar tanto de catalizadores homogéneos como heterogéneos. Se trata de catalizadores con varios centros (engl.: multiple site) activos diferentes. Los sistemas más modernos emplean sobre todo cloruro de magnesio, tetracloruro de titanio, trietilaluminio además de diversos dadores de electrones internos y externos. Pueden alcanzar una producción de hasta 150.000 kg de polímero por gramo de titanio.
Catalizadores modernos (catalizadores Kaminsky)[editar]
Últimamente se utilizan cada vez más sistemas catalíticos basados en metalocenos con metales del grupo 4 con metilaluminiooxanos como co-catalizadores. El metal más empleado es el zirconio por su mayor actividad catalítica frente al titanio o al hafnio. Aunque los sistemas son homogeneos por razones del proceso a menudo se inmovilizan los catalizadores en soportes porosos.
La solubilidad de estos catalizadores ha permitido también investigar y entender el mecanismo de las reacciones Ziegler-Natta. Además se puen diseñar compuestos con sustituyentes quirales y ángulos de apertura (engl.: bite angle) determiandos para controlar aún mejor la reacción.
Mecanismo[editar]
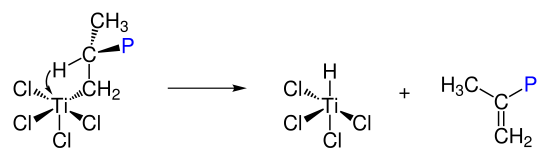
Para el proceso Ziegler-Natta se requiere un complejo de metal de transición del grupo 4 a 8 de geometríaoctaédrica con una posición de coordinación libre.
Este se forma inicialmente a partir de los componentes metálicos y metalorgánicos. La vacante de coordinación tiene propiedades de ácido de Lewis. El mecanismo de un proceso tipo Ziegler-Natta se basa en primero la adición del alqueno al centro metálico con los electrones del enlace doble y luego la inserción en el enlace del metal con el carbono del resto orgánico enlazado previamente. Así se regenera la vacante de coordinación y el ciclo catalítico empieza de nuevo.
En la ecuación del ejemplo se ve cómo se coordina una molécula de propileno a un centro metálico de titanio y luego pasando por un estado cíclico inserta en el enlace del metal con el polímero formado previamente. Esta reacción es estereoespecífica. El grupo metilo siempre se insertará al mismo lado de la cadena. El crecimiento del polímero termina cuando o se ha consumido todo el monmómero o se forma un hidruro por una reacción de eliminación:
El ciclo de Born–Haber es un ciclo de reacciones químicas desarrollado en un principio por el físico Max Born y el químico alemán Fritz Haber en 1917.
El ciclo de Born–Haber comprende la formación de un compuesto iónico desde la reacción de un metal(normalmente un elemento del grupo 1 o 2) con un no metal (como gases, halógenos, oxígeno u otros). Los ciclos de Born–Haber se usan principalmente como medio para calcular la energía reticular, que no puede ser determinada experimentalmente.
La formación de iones gaseosos exige los siguientes procesos energéticos: 1- un átomo de un metal necesita una cierta energía- energía de ionización, E para liberar uno o varios electrones. 2- un átomo de un no metal cuando capta uno o varios electrones desprende energía -afinidad electrónica, Ae. Podría pensarse que solo se formarían compuestos iónicos en el caso de que la energía liberada cuando el no metal capta electones, Ae, iguale o supere a la requerida para la ionización del metal, Ei. Sin embargo esto solo sucede en muy contados casos. Existen muchas sustancias iónicas – por ejemplo el cloruro de sodio- que son estables a pesar de que la energía de ionización del metal supera la electroafinidad del no metal. Todo esto hace sospechar que además de las dos clases de energía mencionadas existan otras que influyan también en la formación del compuesto.
La energía reticular representa teóricamente la formación de compuestos iónicos a partir de iones gaseosos. Algunos químicos la definen como la energía para romper los compuestos iónicos en iones gaseosos. La primera definición es exotérmica y la segunda endotérmica.
Con el ciclo de Born–Haber se calcula la energía reticular comparando la entalpía estándar de formación del compuesto iónico (según los elementos) con la entalpía necesaria para hacer iones gaseosos a partir de los elementos. Esta es una aplicación de la Ley de Hess
El último paso es complejo. Para hacer iones gaseosos de elementos es necesario convertirlos en gas, disociarlos si es necesario, e ionizarlos. Si el elemento es una molécula (por ejemplo F2), habrá que tener en cuenta su entalpía de disociación. La energía necesaria para arrancar un electrón y formar un catión es la energía de ionización, mientras que la necesaria para añadirlo y formar un anión es la afinidad electrónica.
La entalpía de formación se encuentra sumando las entalpías de atomatización, ionización, sublimación, disociación, afinidad electrónica y su respectiva energía reticular.
El ciclo de Calvin (también conocido como ciclo de Calvin-Benson o ciclo de la fijación del carbono de la fotosíntesis) consiste en una serie de procesos bioquímicos que se realizan en el estroma de los cloroplastos de los organismos fotosintéticos.
Las reacciones del ciclo de Calvin pertenecen a la llamada fase independiente de la luz, que se encarga de fijar el CO2, incorporándolo a la materia orgánica del individuo en forma de glucosa mediante la enzima RuBisCo. Cabe destacar que este conjunto de reacciones se denomina erróneamente fase oscura, pues muchas de las enzimas del proceso, entre ellas la RuBisCo, dependen de la activación del sistema ferredoxina-tiorredoxina, que solo se encuentra en su forma activa (la reducida) en presencia de la luz.
El ciclo de Calvin fue descubierto por Melvin Calvin, James Bassham y Andrew Benson de la Universidad de California, Berkeley, mediante el empleo de isótopos radiactivos de carbono-14.1 Calvin fue galardonado con el Premio Nobel de Química en 1961 «por sus trabajos sobre la asimilación del dióxido de carbono por las plantas».
Etapas[editar]
El ciclo se resume en tres etapas:
- Etapa 1. Fijación, carboxilación de difosfato de ribulosa para formar PGA.
- Etapa 2. Reducción de PGA al nivel de un azúcar (CH2O) mediante la formación de gliceraldehído-3-fosfato (GAP) con el NADPH y el ATP que se producen en las reacciones dependientes de la luz.
- Etapa 3. Regeneración de difosfato de ribulosa, que también requiere ATP.
Función[editar]
Se utilizan seis moléculas de CO2 para generar una molécula de glucosa. En estas reacciones cada una de las moléculas de CO2 es unida a una molécula aceptora, ribulosa-1-5-bifosfato (RuBP), que luego se divide en dos moléculas de 3-fosfoglicerato, siendo catalizada por la enzima Rubisco (mediante un proceso de carboxilación sin ATP, utilizando como sustratos CO2 y agua). Luego, el ATP producido durante las reacciones luminosas de la fotosíntesis cede grupos fosfato a estas moléculas, dando lugar a 1,3-difosfoglicerato; al mismo tiempo el NADPH cede electrones a estas moléculas de tres carbonos, dando lugar a gliceraldehido-3-fosfato. Una parte del gliceraldehido-3-fosfato es utilizado para fabricar el azúcar de 6 carbonos de glucosa, entre otros productos de la fotosíntesis. Otra parte del gliceraldehido-3-fosfato es utilizado en conjunto de una molécula de ATP, para generar el aceptor de CO2 ribulosa-1,5-bifosfato y comenzar el ciclo de nuevo.
A cada vuelta completa del ciclo, una molécula de dióxido de carbono entra en el ciclo y es reducida, presentando regeneración de una molécula de RuBP.
Seis vueltas del ciclo, con la introducción de seis átomos de carbono, son necesarios para producir un azúcar de seis carbonos, tal como la glucosa. La ecuación general para la producción de una molécula de glucosa es:
El producto del ciclo es el gliceraldehído 3-fosfato, la molécula primaria transportada del cloroplasto hacia el citoplasma de la célula. Esta misma triasa fosfato (triasa significa un azúcar de tres carbonos) es formada cuando la molécula de fructuosa 1.6 bifosfato es rota en la cuarta etapa de la glucólisis y es inconvertible con otra triasa fosfato, la dihidroxiacetona.
Utilizando la proveniente de la hidrólisis de enlaces fosfato, las primeras cuatro etapas de la glucólisis pueden ser revertidas para formar glucosa a partir del gliceraldehído 3-fosfato.
Entre otras funciones, cada 3 vueltas en el ciclo, una molécula de triosa fosfato es regenerada a partir de 3 moléculas de CO2. La triosa fosfato puede ser utilizada para la síntesis de almidón.
Importancia[editar]
En algas y en plantas superiores existe un único mecanismo primario de carboxilación que resulta en una síntesis de compuestos de carbono: El Ciclo de Calvin o vía de las pentosas fosfato. Su importancia biológica radica en que es la única ruta para los organismos autótrofos, ya sean fotosintetizadores o quimiosintetizadores, que permite la incorporación de materia inorgánica a los seres vivos.
Los productos del ciclo de Calvin son de vital importancia para la biosfera, ya que las uniones covalentes de los hidratos de carbono generadas por el ciclo representan la energía total que surge a partir de la obtención de la luz por los organismos fotosintéticos. Estos organismos denominados autótrofos liberan la mayor parte de esta energía mediante la glucólisis y la respiración celular, energía que emplean para mantener su propio desarrollo, crecimiento y reproducción. Una gran cantidad de materia vegetal termina siendo consumida por los heterótrofos, que no pueden sintetizar y dependen de los autótrofos para obtener materias primas y fuentes de energía. La glucólisis y la respiración celular en las células de los heterótrofos liberan energía libre de los alimentos para su uso en estos organismos.





No hay comentarios:
Publicar un comentario