Cronotropismo es un efecto que tienen algunas sustancias sobre el ritmo cardíaco. Aquellas que son cronotrópicos positivos, aceleran la frecuencia cardíaca, mientras que los que tienen un efecto cronotrópico negativo producen disminución de la frecuencia cardíaca. Por ejemplo, el sistema nervioso simpático produce taquicardia por lo que es cronotrópico positivo, en cambio el sistema nervioso parasimpático es cronotrópico negativo porque disminuye la frecuencia cardíaca.
Canales de sodio[editar]
El ritmo del corazón se produce, en condiciones no patológicas, en una agrupación de células conocida como el nódulo sinusal. Estas células tienen un tipo de proteínas de membrana denominadas canales de sodio . Son canales de sodio-potasio, que se encuentran abiertos cuando los canales de sodio típicos de cualquier célula estarían cerrados. Esto provoca una lenta despolarización de la célula hasta el potencial umbral, a partir del cual se origina la contracción del corazón. Así, los canales de sodio regulan la frecuencia de las contracciones cardíacas.1
Las sustancias cronótropas son aquellas que promueven la apertura de los canales de sodio "funny" (If) y así, la rápida despolarización y el aumento de la frecuencia cardíaca.23 Con el envejecimiento se produce una disminución en la respuesta cronotrópica, mediada por estímulo β-adrenérgico, la cual se debe a un incremento transitorio del calcio intracelular que es necesario para la contracción muscular.
dromotropismo o conductibilidad se refiere a la capacidad que presenta el corazón de realizar la transmisión de impulsos eléctricos a través del sistema de conducción eléctrica del corazón. Los impulsos que circulan por este sistema son los que provocan la contracción del miocardio, haciendo posible el funcionamiento adecuado del corazón como una bomba que impulsa la sangre hacia los tejidos. Se entiende por dromotropismo positivo al efecto de aumentar la velocidad de conducción de los estímulos, por el contrario dromotropismo negativo es la acción contraria. Numerosos fármacos utilizados en medicina tienen efecto dromotrópico positivo, entre ellos la adrenalina. También se emplean medicamentos con efecto dromotrópico negativo, como el digital, la amiodarona y el verapamil, útiles en el tratamiento de determinadas arritmias en las que la conducción del impulso eléctrico por el corazón es demasiado veloz.12
Propiedades del corazón[editar]
El dromotropismo se considera clásicamente como una de las 4 propiedades fundamentales del corazón:
- Inotropismo o capacidad de contracción.
- Cronotropismo, también llamado automatismo.
- Dromotropismo o conductividad.
- Batmotropismo o excitabilidad.
Velocidad de conducción[editar]
En condiciones normales el impulso nervioso se genera en el nodo sinusal del corazón, desde donde se distribuye a las aurículas, el impulso tarda únicamente 0,09 segundos en llegar al extremo de las aurículas y más del doble (0,22 segundos) en alcanzar el último extremo del ventrículo, ello se debe en parte a que se produce un retardo de 0,12 segundos en la transmisión aurículo-ventricular. Por este motivo se contraen primero las aurículas y posteriormente los ventrículos, lo que hace posible una función eficaz del corazón.
CONDUCTIBILIDAD O DROMOTROPISMO. (Figura)
|
Todas las células del corazón conducen el potencial de acción sin decremento, excitando las células vecinas a través de las gap-junctions existentes. La propagación del Va (potencial de acción) por el sistema conductor es dirigida en un sentido, pero en la masa muscular es radial. Sin embargo la mecánica cardiaca requiere una sincronización entre la contracción de las aurículas, que vierten sangre en los ventrículos y la contracción de los ventrículos. Para ello, existe una desconexión funcional entre aurículas y ventrículos, gracias al anillo fibroso valvular, por lo que la única conexión entre aurículas y ventrículos se produce por el tejido conductor. La activación auricular supone la activación muscular casi simultánea de todo el miocardio auricular. La activación ventricular supone, debido a la mayor masa muscular, una activación secuencial que va desde el endocardio al epicardio y desde el septum al ápice y de ahí a las bases ventriculares.
Como se ve en la figura, la transmisión del impulso generado en el nodo SA, tarda en llegar al último punto auricular 0,09 s, mientas que al último extremo ventricular tarda 0,22 s. En la transmisión aurículo - ventricular se produce un retardo de 0,12 s.
LA VELOCIDAD con que una célula propaga el Va en su membrana depende de las características de su Va y de su resistencia eléctrica longitudinal. Cuanto más amplia y pendiente sea la fase 0 de su Va y más gruesa sea su sección, más rápidamente propagará el Va. Esto explica que los nódulos conduzcan muy lentamente, pues sus células son pequeñas con un potencial lento, y que las fibras de Purkinje sean las más rápidas pues son células más grandes y presentan un Va rápido. (Ver tabla)
Los factores que influyen en la velocidad de propagación del Va son:
- pendiente de la fase 0
- tiempo de repolarización
- amplitud del potencial capaz de despolarizar a células adyacentes.
- concentración extracelular de potasio
- diámetro de las fibras
- actividad del sistema nervioso
- drogas
Como se ve en la figura, la transmisión del impulso generado en el nodo SA, tarda en llegar al último punto auricular 0,09 s, mientas que al último extremo ventricular tarda 0,22 s. En la transmisión aurículo - ventricular se produce un retardo de 0,12 s.
LA VELOCIDAD con que una célula propaga el Va en su membrana depende de las características de su Va y de su resistencia eléctrica longitudinal. Cuanto más amplia y pendiente sea la fase 0 de su Va y más gruesa sea su sección, más rápidamente propagará el Va. Esto explica que los nódulos conduzcan muy lentamente, pues sus células son pequeñas con un potencial lento, y que las fibras de Purkinje sean las más rápidas pues son células más grandes y presentan un Va rápido. (Ver tabla)
Los factores que influyen en la velocidad de propagación del Va son:
- pendiente de la fase 0
- tiempo de repolarización
- amplitud del potencial capaz de despolarizar a células adyacentes.
- concentración extracelular de potasio
- diámetro de las fibras
- actividad del sistema nervioso
- drogas
CONDUCCIÓN AURICULAR (Figura)
El potencial de acción (Va) generado en el nodo sinusal activa inicialmente a las células musculares auriculares. En el nodo sinusal se distinguen dos tipos de células las células P o pacemaker, ovoideas y pálidas y las células T o de transición, de forma alargada que se sitúan entre las células P y las células musculares auriculares. El impulso se propaga como una onda circular que invade progresivamente todas las células musculares de la pared auricular a una velocidad de 1 m/s.
Para explicar la contracción sincrónica de ambas aurículas, a pesar de la diferente distancia que el potencial de acción recorre para activar las células contráctiles de la aurícula izq. y derecha, se ha propuesto que existen vías preferentes de conducción que conducen el potencial de acción a mayor velocidad (el fascículo interatrial o de Bachmann y el internodal , anterior, medio y posterior) aunque no se ha demostrado la existencia de tejido específico de conducción en la masa muscular auricular. Se estima que es la propia ordenación espacial de las fibras musculares auriculares las que constituyen estas vías preferentes funcionales.
La onda de despolarización tarda unos 40 ms. en llegar al nodo AV y unos 90 a las células más alejadas de la aurícula izquierda.
El potencial de acción (Va) generado en el nodo sinusal activa inicialmente a las células musculares auriculares. En el nodo sinusal se distinguen dos tipos de células las células P o pacemaker, ovoideas y pálidas y las células T o de transición, de forma alargada que se sitúan entre las células P y las células musculares auriculares. El impulso se propaga como una onda circular que invade progresivamente todas las células musculares de la pared auricular a una velocidad de 1 m/s.
Para explicar la contracción sincrónica de ambas aurículas, a pesar de la diferente distancia que el potencial de acción recorre para activar las células contráctiles de la aurícula izq. y derecha, se ha propuesto que existen vías preferentes de conducción que conducen el potencial de acción a mayor velocidad (el fascículo interatrial o de Bachmann y el internodal , anterior, medio y posterior) aunque no se ha demostrado la existencia de tejido específico de conducción en la masa muscular auricular. Se estima que es la propia ordenación espacial de las fibras musculares auriculares las que constituyen estas vías preferentes funcionales.
La onda de despolarización tarda unos 40 ms. en llegar al nodo AV y unos 90 a las células más alejadas de la aurícula izquierda.
CONDUCCIÓN AURICULO-VENTRICULAR (Figura)
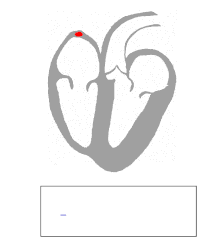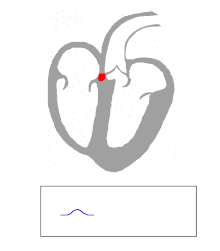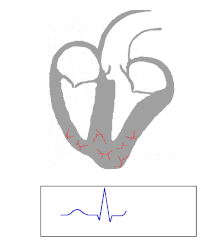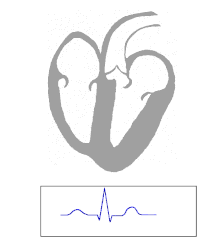
El potencial de acción (Va) a la vez que activa las fibras musculares auriculares alcanza el nódulo atrioventricula(NAV), situado en el lado derecho del septum interauricular, próximo a la válvula tricúspide y el seno coronario.
En el NAV se distinguen funcionalmente 3 regiones:
1. La aurículo-nodal (AN) formada por células de transición (T) que se sitúan entre las células contráctiles y las de la región nodal.
2. La región Nodal (N) en la que predominan células pequeñas de Va lento y muy poco excitables. En esta región se produce:
2.1. Un retardo en la conducción del Va. Se reduce a 0.02-0.05 m/s la velocidad de conducción y la despolarización del haz de His no ocurre hasta 90-100 ms. después de haberse activado el nódulo. Este retardo determina que las aurículas y los ventrículos no se contraigan al mismo tiempo, permitiendo que la sangre impelida por la contracción auricular pueda llenar los ventrículos antes que estos se contraigan.
2.2. Un bloqueo en la conducción cuando el número de impulsos que alcanzan al NAV es superior a su capacidad máxima de conducción. El periodo refractario relativo de las células de la región N es muy largo y esto limita a 180 el número máximo de impulsos que es capaz de conducir por minuto. Cuando la frecuencia de Va que llegan a esta región es mayor, se encuentran a las células en PRA y por tanto, no excitables, bloqueándose su conducción.
2.3. Una conducción anterógrada, pues aunque la conducción retrógrada (desde ventrículos a aurículas) puede ocurrir es poco probable, pues la velocidad de conducción en sentido retrógrado es menor que en el anterógrado y por tanto el número de impulsos que pueden circular en sentido inverso es menor y se bloquean antes.
3. La región de transición entre el nódulo y el haz de His (NH) en la que existen células de transición y células P que son las que funcionan como marcapasos cuando se bloquea totalmente la conducción aurículo-ventricular.
En algunas ocasiones la activación se propaga además de por la vía normal (NAV-Haz de His), por una derivación secundaria de fibras rápidas que comunican la aurícula con el ventrículo. Se crea así un mecanismo de reentrada que lleva a una sobreexcitación ventricular, síndrome de pre-excitación ventricular o de Wolff - Parkinson - White.
Los antagonistas del Ca2+ retrasan la conducción aurículo-ventricular, así como la estimulación vagal o la aplicación de fármacos como la adenosina o la digital. La estimulación simpática acelera el tiempo de conducción.
El potencial de acción (Va) a la vez que activa las fibras musculares auriculares alcanza el nódulo atrioventricula(NAV), situado en el lado derecho del septum interauricular, próximo a la válvula tricúspide y el seno coronario.
En el NAV se distinguen funcionalmente 3 regiones:
1. La aurículo-nodal (AN) formada por células de transición (T) que se sitúan entre las células contráctiles y las de la región nodal.
2. La región Nodal (N) en la que predominan células pequeñas de Va lento y muy poco excitables. En esta región se produce:
2.1. Un retardo en la conducción del Va. Se reduce a 0.02-0.05 m/s la velocidad de conducción y la despolarización del haz de His no ocurre hasta 90-100 ms. después de haberse activado el nódulo. Este retardo determina que las aurículas y los ventrículos no se contraigan al mismo tiempo, permitiendo que la sangre impelida por la contracción auricular pueda llenar los ventrículos antes que estos se contraigan.
2.2. Un bloqueo en la conducción cuando el número de impulsos que alcanzan al NAV es superior a su capacidad máxima de conducción. El periodo refractario relativo de las células de la región N es muy largo y esto limita a 180 el número máximo de impulsos que es capaz de conducir por minuto. Cuando la frecuencia de Va que llegan a esta región es mayor, se encuentran a las células en PRA y por tanto, no excitables, bloqueándose su conducción.
2.3. Una conducción anterógrada, pues aunque la conducción retrógrada (desde ventrículos a aurículas) puede ocurrir es poco probable, pues la velocidad de conducción en sentido retrógrado es menor que en el anterógrado y por tanto el número de impulsos que pueden circular en sentido inverso es menor y se bloquean antes.
3. La región de transición entre el nódulo y el haz de His (NH) en la que existen células de transición y células P que son las que funcionan como marcapasos cuando se bloquea totalmente la conducción aurículo-ventricular.
En algunas ocasiones la activación se propaga además de por la vía normal (NAV-Haz de His), por una derivación secundaria de fibras rápidas que comunican la aurícula con el ventrículo. Se crea así un mecanismo de reentrada que lleva a una sobreexcitación ventricular, síndrome de pre-excitación ventricular o de Wolff - Parkinson - White.
Los antagonistas del Ca2+ retrasan la conducción aurículo-ventricular, así como la estimulación vagal o la aplicación de fármacos como la adenosina o la digital. La estimulación simpática acelera el tiempo de conducción.
CONDUCCIÓN VENTRICULAR (Figura)
Activado el haz de His, el potencial de acción se propaga a través de dicho haz, cursando por el endocardio hacia el lado derecho del septum unos 12 mm para dividirse en dos ramas. La derecha, que es continuación del haz y desciende por el lado derecho del septum; y la izquierda (de mayor diámetro) que sale perpendicularmente y cruza el tabique, bifurcándose a su vez en en una división anterior y otra posterior. Luego se ramifican en una red extensa de fibras: las fibras de Purkinje (las células cardíacas más grandes (70-80 um)). La alta velocidad de conducción (1-4 m/s) permite que se activen con muy poca diferencia de tiempo ambos ventrículos. Primero se activa todo el endocardio siguiendo a menor velocidad (0,3 a 0,4 m/s)la activación del epicardio.
La contracción ventricular se inicia en el septum (haciéndose más rígido y actuando como punto de anclaje para el resto del músculo cardíaco) y los músculos papilares (evitando la reversión valvular durante la eyección ventricular). Aunque la masa del ventrículo derecho es menor que la del izquierdo, la contracción es casi simultánea en ambos, debido a un aumento en la velocidad de conducción de la rama izquierda, ya que las fibras conductoras tienen mayor diámetro. El ápice se contrae antes que las bases ventriculares.
Las fibras de Purkinje presentan un tiempo de meseta mayor que en las células contráctiles, lo que les supone un mayor PRA, por lo que actúan como freno frente a despolarizaciones auriculares prematuras, con mayor efectividad a bajas frecuencias, ya que la duración del PRA de estas fibras es inverso a la frecuencia de despolarización.
La despolarización ventricular invierte unos 75 ms..
Activado el haz de His, el potencial de acción se propaga a través de dicho haz, cursando por el endocardio hacia el lado derecho del septum unos 12 mm para dividirse en dos ramas. La derecha, que es continuación del haz y desciende por el lado derecho del septum; y la izquierda (de mayor diámetro) que sale perpendicularmente y cruza el tabique, bifurcándose a su vez en en una división anterior y otra posterior. Luego se ramifican en una red extensa de fibras: las fibras de Purkinje (las células cardíacas más grandes (70-80 um)). La alta velocidad de conducción (1-4 m/s) permite que se activen con muy poca diferencia de tiempo ambos ventrículos. Primero se activa todo el endocardio siguiendo a menor velocidad (0,3 a 0,4 m/s)la activación del epicardio.
La contracción ventricular se inicia en el septum (haciéndose más rígido y actuando como punto de anclaje para el resto del músculo cardíaco) y los músculos papilares (evitando la reversión valvular durante la eyección ventricular). Aunque la masa del ventrículo derecho es menor que la del izquierdo, la contracción es casi simultánea en ambos, debido a un aumento en la velocidad de conducción de la rama izquierda, ya que las fibras conductoras tienen mayor diámetro. El ápice se contrae antes que las bases ventriculares.
Las fibras de Purkinje presentan un tiempo de meseta mayor que en las células contráctiles, lo que les supone un mayor PRA, por lo que actúan como freno frente a despolarizaciones auriculares prematuras, con mayor efectividad a bajas frecuencias, ya que la duración del PRA de estas fibras es inverso a la frecuencia de despolarización.
La despolarización ventricular invierte unos 75 ms..
MECANISMO DE REENTRADA (Figura)
Este fenómeno se explica porque normalmente, cuando entra el potencial de acción (Va) en los ventrículos y excita a todas sus células miocárdicas, una vez contraídas todas se encuentran en fase de repolarización y por tanto refractarias, por lo que dicho Va se extingue. Hasta que no llega otro Va nuevo no se produce una nueva excitación y contracción miocárdica. Ahora bien, si el Va que normalmente se extingue por no encontrar células excitables las encontrara, volvería a producir despolarización y contracción parcial, es decir se produciría un fenómeno de reentrada del Va.
Posibles mecanismos que favorecen este fenómeno:
- Cuando el trayecto del impulso es suficientemente largo como para que cuando vuelva el Va se encuentre ya células repolarizadas y excitables (corazones dilatados).
- Si disminuye la velocidad suficientemente como para que de tiempo a la repolarización de las células (bloqueo en el sistema de Purkinje, isquemia muscular, concentraciones elevadas de K+, etc.)
- Por disminución del periodo refractario celular (adrenalina, estímulos eléctricos repetidos, etc).
Este fenómeno se explica porque normalmente, cuando entra el potencial de acción (Va) en los ventrículos y excita a todas sus células miocárdicas, una vez contraídas todas se encuentran en fase de repolarización y por tanto refractarias, por lo que dicho Va se extingue. Hasta que no llega otro Va nuevo no se produce una nueva excitación y contracción miocárdica. Ahora bien, si el Va que normalmente se extingue por no encontrar células excitables las encontrara, volvería a producir despolarización y contracción parcial, es decir se produciría un fenómeno de reentrada del Va.
Posibles mecanismos que favorecen este fenómeno:
- Cuando el trayecto del impulso es suficientemente largo como para que cuando vuelva el Va se encuentre ya células repolarizadas y excitables (corazones dilatados).
- Si disminuye la velocidad suficientemente como para que de tiempo a la repolarización de las células (bloqueo en el sistema de Purkinje, isquemia muscular, concentraciones elevadas de K+, etc.)
- Por disminución del periodo refractario celular (adrenalina, estímulos eléctricos repetidos, etc).
FACTORES MODULADORES DE LA VELOCIDAD DE CONDUCCIÓN (Ver Figura)
ELECTROCARDIOGRAMA (Figura)
|
Sobre la base de las propiedades conductoras de los líquidos corporales (teoría del conductor de volumen), las corrientes eléctricas generadas en el corazón durante cada ciclo cardíaco, determinan campos eléctricos que se extienden por el líquido electrolítico corporal, los cuales generan diferencias de potencial entre electrodos colocados debidamente en la superficie corporal. Así podemos obtener de una forma incruenta la evolución eléctrica del ciclo cardíaco.
El conjunto de ondas e intervalos obtenidos durante un ciclo cardíaco, como consecuencia del registro superficial de la actividad eléctrica cardíaca es lo que denominamos ELECTROCARDIOGRAMA. De él podemos obtener información del estado funcional del corazón en cuanto a su excitación y propagación del potencial de acción, así como de las posibles alteraciones asociadas que afectan al ritmo y a la efectividad mecánica cardiaca.
El registro electrocardiográfico refleja en papel o monitor, la gráfica resultante de como "ven" los electrodos de registro situados en la superficie corporal, los cambios eléctricos que se producen en cada ciclo cardíaco. Es decir, si hay corrientes y si éstas van o vienen hacia los electrodos exploradores, así como la intensidad de las mismas. Las corrientes son siempre extracelulares.
La amplitud de las corrientes depende de la dirección de la corriente con respecto al electrodo explorador y de la intensidad de las corrientes extracelulares durante el paso del potencial de acción, y esta última depende del número de células activas en cada momento. De acuerdo con la constitución celular cardíaca, son las células musculares auriculares y ventriculares las únicas que por su número son capaces de generar corrientes extracelulares medibles. No obstante, estas corrientes son demasiados pequeñas (< 1 mV) lo que supone la necesidad de su amplificación para que puedan ser registradas. (Calibración 1 mV = 1 cm). Cuando el registro es en papel, éste se mueve a una velocidad de 25 mm/s.
El método fue desarrollado a principios de siglo XX por Willem Eithoven en Leiden y Augustus Waller en Londres.
El conjunto de ondas e intervalos obtenidos durante un ciclo cardíaco, como consecuencia del registro superficial de la actividad eléctrica cardíaca es lo que denominamos ELECTROCARDIOGRAMA. De él podemos obtener información del estado funcional del corazón en cuanto a su excitación y propagación del potencial de acción, así como de las posibles alteraciones asociadas que afectan al ritmo y a la efectividad mecánica cardiaca.
El registro electrocardiográfico refleja en papel o monitor, la gráfica resultante de como "ven" los electrodos de registro situados en la superficie corporal, los cambios eléctricos que se producen en cada ciclo cardíaco. Es decir, si hay corrientes y si éstas van o vienen hacia los electrodos exploradores, así como la intensidad de las mismas. Las corrientes son siempre extracelulares.
La amplitud de las corrientes depende de la dirección de la corriente con respecto al electrodo explorador y de la intensidad de las corrientes extracelulares durante el paso del potencial de acción, y esta última depende del número de células activas en cada momento. De acuerdo con la constitución celular cardíaca, son las células musculares auriculares y ventriculares las únicas que por su número son capaces de generar corrientes extracelulares medibles. No obstante, estas corrientes son demasiados pequeñas (< 1 mV) lo que supone la necesidad de su amplificación para que puedan ser registradas. (Calibración 1 mV = 1 cm). Cuando el registro es en papel, éste se mueve a una velocidad de 25 mm/s.
El método fue desarrollado a principios de siglo XX por Willem Eithoven en Leiden y Augustus Waller en Londres.
Definición de los componentes característicos de un registro electrocardiográfico tomados en la derivación bipolar II
Segmentos: trayectos que se encuentran entre dos puntas u ondas.
Intervalo: abarca ondas y segmentos.
Onda P: onda de despolarización del músculo auricular. Su amplitud normal no debe exceder los 0,25 mV
Intervalo PQ: tiempo invertido en la propagación de la excitación por la aurículas, nodo AV, haz de His y las ramas ventriculares (0,18 a 0,20 s), el mayor tiempo se invierte en el cruce del nodo AV.
Complejo QRS: onda de despolarización ventricular. Tiempo =< 0,1 s. Si la duración es mayor de =,12 s es índice de trastornos en la conducción ventricular.
Onda Q: deflexión que precede a la R y corresponde a la despolarización del tabique interventricular.
Onda R: deflexión que corresponde al vector que representa la despolarización de la masa ventricular.
Onda S: deflexión que sigue a la onda R y corresponde con la despolarización de las zonas basales ventriculares.
Segmento ST: línea isopotencial que representa la fase meseta de todas las células ventriculares, coincide con la contracción ventricular. Su duración depende de la frecuencia.
TAV: (deflexión Intrinsecoide o Tiempo de Activación Ventricular) tiempo transcurrido entre el inicio del complejo QRS y el nadir de la onda R
Punto J: Es el punto isoeléctrico y se alcanza cuando todo el ventrículo está despolarizado.
Onda T: onda de repolarización ventricular. Tiene la misma polaridad que la onda R.
La repolarización no es simétrica a la despolarización, porque es más rápida en la punta del corazón que en la base y en la pared externa del corazón que en la interna.
Onda U: aparece algunas veces. Origen no bien establecido.
Intervalo QT: representa la duración total de la sístole eléctrica ventricular. Normalmente oscila entre 0,32 y 0,40 s.
Segmento TP: línea isopotencial de inactividad cardíaca.
Intervalo RR: corresponde a la duración de un periodo cardíaco. Se utiliza para medir la frecuencia cardíaca. Tiempo normal es de 0,8 s., lo que supone una frecuencia de 75 latidos/min.
La repolarización auricular no puede verse, dada la pequeña masa muscular, quedando oculta por la despolarización ventricular.
Segmentos: trayectos que se encuentran entre dos puntas u ondas.
Intervalo: abarca ondas y segmentos.
Onda P: onda de despolarización del músculo auricular. Su amplitud normal no debe exceder los 0,25 mV
Intervalo PQ: tiempo invertido en la propagación de la excitación por la aurículas, nodo AV, haz de His y las ramas ventriculares (0,18 a 0,20 s), el mayor tiempo se invierte en el cruce del nodo AV.
Complejo QRS: onda de despolarización ventricular. Tiempo =< 0,1 s. Si la duración es mayor de =,12 s es índice de trastornos en la conducción ventricular.
Onda Q: deflexión que precede a la R y corresponde a la despolarización del tabique interventricular.
Onda R: deflexión que corresponde al vector que representa la despolarización de la masa ventricular.
Onda S: deflexión que sigue a la onda R y corresponde con la despolarización de las zonas basales ventriculares.
Segmento ST: línea isopotencial que representa la fase meseta de todas las células ventriculares, coincide con la contracción ventricular. Su duración depende de la frecuencia.
TAV: (deflexión Intrinsecoide o Tiempo de Activación Ventricular) tiempo transcurrido entre el inicio del complejo QRS y el nadir de la onda R
Punto J: Es el punto isoeléctrico y se alcanza cuando todo el ventrículo está despolarizado.
Onda T: onda de repolarización ventricular. Tiene la misma polaridad que la onda R.
La repolarización no es simétrica a la despolarización, porque es más rápida en la punta del corazón que en la base y en la pared externa del corazón que en la interna.
Onda U: aparece algunas veces. Origen no bien establecido.
Intervalo QT: representa la duración total de la sístole eléctrica ventricular. Normalmente oscila entre 0,32 y 0,40 s.
Segmento TP: línea isopotencial de inactividad cardíaca.
Intervalo RR: corresponde a la duración de un periodo cardíaco. Se utiliza para medir la frecuencia cardíaca. Tiempo normal es de 0,8 s., lo que supone una frecuencia de 75 latidos/min.
La repolarización auricular no puede verse, dada la pequeña masa muscular, quedando oculta por la despolarización ventricular.
La fracción de eyección (FEVI o MUGA) de un corazón es la medida más importante del funcionamiento cardíaco. Este valor, expresado en porcentaje, mide la disminución del volumen del ventrículo izquierdo del corazón en sístole, con respecto a la diástole, por lo que una fracción de eyección del 50% significa que el corazón, al contraerse, reduce el volumen de su ventrículo izquierdo a la mitad, con respecto a su posición relajada. Los valores normales de fracciones de eyección es de mayor o igual a 50%. Valores entre 40% y 50% pueden significar un principio de insuficiencia cardíaca. Valores menores de 30% indican una insuficiencia moderada.
En pacientes que han sufrido un Infarto Agudo al Miocardio (IAM), la fracción de eyección sirve como un indicador de riesgo (junto con otros elementos).
- Bajo riesgo: Fracción de eyección mayor o igual a 50%
- Riesgo moderado: Fracción de eyección entre 36-49%
- Alto riesgo: Fracción de eyección menor o igual a 35%
Fórmula[editar]
La fracción de eyección se calcula con la fórmula:
- FE: Fracción de Eyección
- VS= Volumen sistólico
- VDF= Volumen diastólico final
- VSF= Volumen sistólico final
Por tanto la fracción de eyección es igual al volumen diastólico final menos el volumen sistólico final, dividido por el volumen diastólico final y multiplicado por 100.
La fracción de eyección es la medición del porcentaje de sangre que expulsa el corazón cada vez que se contrae.
En cada ciclo de latido del corazón, este se contrae y se relaja. Cuando el corazón se contrae, expulsa sangre de las dos cámaras de bombeo (ventrículos). Cuando el corazón se relaja, los ventrículos se vuelven a llenar de sangre. Más allá de la fuerza de la contracción, la sangre nunca se expulsa por completo del ventrículo. La expresión “fracción de eyección” se refiere al porcentaje de sangre que se expulsa de un ventrículo lleno con cada latido del corazón.
El ventrículo izquierdo es la cámara de bombeo principal del corazón que bombea sangre oxigenada a través de la aorta ascendente hacia el resto del cuerpo, por lo que la fracción de eyección habitualmente se mide solo en el ventrículo izquierdo. Se considera que una fracción de eyección del ventrículo izquierdo del 55 por ciento o superior es normal. Se considera que una fracción de eyección del ventrículo izquierdo del 50 por ciento o inferior es reducida. Los expertos varían en su opinión sobre la fracción de eyección de entre el 50 y el 55 por ciento, y algunos consideran que este intervalo es “limítrofe”.
Se debe tener en cuenta que la fracción de eyección es solo una medición de la función cardíaca. Aunque la fracción de eyección sea normal, la función cardíaca global puede no ser normal. Habla con tu médico si tienes alguna inquietud relacionada con el corazón.
La fracción de eyección puede disminuir en los siguientes casos:
- Debilidad del músculo cardíaco, como cardiomiopatía dilatada, que puede deberse a un problema en el músculo cardíaco, a una cardiomiopatía hereditaria (genética) o a enfermedades sistémicas
- Lesiones en el corazón debido a un ataque cardíaco
- Problemas en las válvulas del corazón
- Presión arterial alta no controlada desde hace mucho tiempo
La fracción de eyección puede medirse mediante técnicas de diagnóstico por imágenes, que incluyen lo siguiente:
- Ecocardiograma. Durante un ecocardiograma, se utilizan ondas sonoras para crear imágenes del corazón y de la sangre que bombea a través del corazón. Este es el método más frecuente para evaluar la fracción de eyección. Los otros métodos son poco comunes.
- Cateterismo cardíaco. En el cateterismo cardíaco, se introduce un tubo delgado de plástico (catéter) en una arteria del brazo o la pierna y luego se lleva hasta el corazón. Durante el cateterismo, pueden tomarse imágenes para evaluar la fracción de eyección del corazón.
- Resonancia magnética (RM). Durante una RM, se usan ondas de radio y un campo magnético para crear imágenes transversales de partes específicas del cuerpo. Cuando se usa una RM para estudiar el corazón, esta se conoce como RM cardiovascular.
- Tomografía computarizada (TC). Durante una exploración de TC, se usa una técnica especial de radiografías para crear imágenes transversales de partes específicas del cuerpo. Cuando se usa una TC para estudiar el corazón, esta se conoce como TC cardíaca.
- Exploración de medicina nuclear. Durante una exploración nuclear, se inyectan en el torrente sanguíneo cantidades mínimas de un material radioactivo, como el talio. Luego, cámaras especiales detectan el material radioactivo en la sangre a medida que esta fluye por el corazón y los pulmones.

No hay comentarios:
Publicar un comentario