isotónico es aquel en el cual la concentración de soluto es igual fuera y dentro de una célula. En hematología, se dice de las soluciones que tienen la misma concentración de sales que los glóbulos rojos. son isotónicas.[cita requerida] Por tanto, tienen la misma presión osmótica que la sangre y no producen la deformación de los glóbulos rojos. Aplicando este término a la contracción muscular, se dice que una contracción es isotónica cuando la tensión del músculo permanece constante.
límite de Hayflick es el número de duplicaciones que puede sufrir una célula eucariota antes de entrar en senescencia.
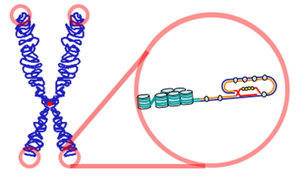
Un cromosoma (izquierda) y un telómero (a la derecha). Cuando el telómero se acorta, la célula llega al límite de Hayflick y muere.
Estudio de Hayflick[editar]
A principios de la década de 1960, el Dr. Leonard Hayflick llevó a cabo una investigación en el "Wistar Institute" en Filadelfia, Pensilvania (Estados Unidos), que se tradujo en el descubrimiento del Límite de Hayflick.
Hayflick descubrió que el tejido proveniente de los pulmones parecía morir después de que las células se hubieran dividido cierto número de veces (alrededor de 50 veces). En un segundo experimento dejó a las células dividirse 25 veces, y las congeló por un tiempo. Al restablecer la temperatura, las células continuaban dividiéndose hasta el límite de unas 50 divisiones, y después morían. A medida que las células se aproximaban a este límite de edad, presentaban cada vez más signos de envejecimiento celular.
Postulado[editar]
Este descubrimiento contradecía lo que se venía creyendo desde principios de siglo. En 1965, como una explicación de las causas de la vejez, el Dr. Hayflick postuló que la cantidad de veces que las células humanas podían dividirse era limitada.1 Por primera vez la ciencia enfocaba su atención en el crecimiento celular para explicar la vejez y los cambios que aparecen con la edad, y por primera vez se establecía una distinción entre células mortales y células inmortales. Esta distinción es la base de una cantidad considerable de trabajos de investigación sobre el cáncer.
Estudios posteriores[editar]
Ahora se sabe una de las razones por la que la vejez celular es causada es por el acortamiento de los telómeros(los extremos de los cromosomas) durante cada división celular. Cuando los telómeros son demasiado cortos, la célula muere: ha llegado al límite de Hayflick.
lionización es un fenómeno por el cual en células de un organismo con múltiples cromosomas X aparecen los llamados Corpúsculos de Barr por la inactivación de todos menos uno de ellos. Estos cuerpos que se observan en células sin división de mamíferos corresponden a la cromatina del cromosoma X de hembras (Mary F. Lyon, 2003) condensada en heterocromatina, y dicha inactivación tiene lugar debido a la metilación de su ADN (lo que silencia sus genes). Forma parte de los mecanismos de compensación de dosis génica, evitándose que las hembras expresen el doble de producto génico por disponer de 2 cromosomas X (frente a un X y otro Y en los machos).
El proceso tiene lugar durante la embriogénesis temprana, y si el cromosoma inactivado es diferente en cada célula puede dar lugar a individuos mosaico como los gatos calico, donde se dan patrones de coloración parcheados. No obstante la desactivación parece no ser completa, expresándose en torno a un 15% de los genes, explicándose así enfermedades de dosis génica como el Síndrome de Klinefenter (XXY) que en un principio no deberían aparecer de funcionar siempre este mecanismo. Aparentemente estos genes corresponden a alelos dominantes que suplen mutaciones defectivas en la copia del cromosoma activo. El fenómeno es irreversible salvo en células de la línea germinal, donde se reactiva al poco de comenzar la meiosis, siendo ambos cromosomas completamente activos en oocitos tempranos.
Generalmente se acepta que el cromosoma metilado se escoge aleatoriamente en mamíferos superiores (salvo en organismos como marsupiales donde siempre es el de origen paterno), pero no obstante podrían existir preferencias según el grupo de edad de la hembra. También se conoce que en el tejido placentario siempre se inactiva el procedente del padre.
Mecanismo[editar]
La mayor parte del proceso es poco conocido, aunque sí se conoce la existencia de un ARN no traducible, Xist, generado por el cromosoma que se inactiva, y que forma un complejo con el propio cromosoma, siendo imprescindible en el proceso inicial de la desactivación pero no en el mantenimiento de la misma.
Este mantenimiento tiene lugar debido a la metilación en el cromosoma inactivado tanto del gen Xist como de promotores de múltiples genes. Así mismo, también interviene la presencia de una histona 2A especial, H2A1, que otorga la condensación característica del corpúsculo de Barr. El corpúsculo también se caracteriza por una escasa acetilación de sus histonas y una infrecuente metilación de la lisina 4 y frecuente de la 9 en H3.
Se conocen centros de inactivación X (XIC) cuya simple presencia es suficiente para el silenciamiento incluso de autosomas, como se ha visto en translocaciones, y que incluye secuencias de unión de proteínas reguladoras y secuencias codificantes de RNAs no traducibles: Xist y Tsix (que se trata de un RNA antisentido de Xist, que lo regula negativamente).
metabolismo microbiano es el conjunto de procesos por los cuales un microorganismo obtiene la energía y los nutrientes (carbono, por ejemplo) que necesita para vivir y reproducirse. Los microorganismos utilizan numerosos tipos de estrategias metabólicas distintas y las especies pueden a menudo distinguirse en función de estas estrategias. Las características metabólicas específicas de un microorganismo constituyen el principal criterio para determinar su papel ecológico, su responsabilidad en los ciclos biogeoquímicos y su utilidad en los procesos industriales.
Tipos de metabolismo microbiano[editar]
Los distintos tipos de metabolismo microbiano se pueden clasificar según tres criterios distintos:
1. La forma la que el organismo obtiene el carbono para la construcción de la masa celular:
- Autótrofo. El carbono se obtiene del dióxido de carbono (CO2).
- Heterótrofo. El carbono se obtiene de compuestos orgánicos (glucosa, por ejemplo).
- Mixótrofo. El carbono se obtiene tanto de compuestos orgánicos como fijando el dióxido de carbono.
2. La forma en la que el organismo obtiene los equivalentes reductores para la conservación de la energía o en las reacciones biosintéticas:
- Litotrofo. Los equivalentes reductores se obtienen de compuestos inorgánicos.
- Organotrofo. Los equivalentes reductores se obtienen de compuestos orgánicos.
3. La forma en la que el organismo obtiene la energía para vivir y crecer:
- Quimiotrofo. La energía se obtiene de compuestos químicos externos.
- Fototrofo. La energía se obtiene de la luz.
En la práctica, estos términos se combinan casi libremente. Los ejemplos típicos son como sigue:
- Los quimiolitoautótrofos obtienen energía de la oxidación de compuestos inorgánicos y el carbono de la fijación del dióxido de carbono. Ejemplos: bacterias nitrificantes, bacterias oxidantes del azufre, bacterias oxidantes del hierro, bacterias oxidantes del hidrógeno.
- Los fotolitoautótrofos obtienen energía de la luz y el carbono de la fijación del dióxido de carbono, usando compuestos inorgánicos como equivalentes reductores. Ejemplos: Cyanobacteria (agua como equivalente reductor), Chlorobiaceae, Chromaticaceae (sulfuro de hidrógeno), Chloroflexus (hidrógeno).
- Los quimiolitoheterótrofos obtienen energía de la oxidación de compuestos inorgánicos, pero no pueden fijar el dióxido de carbono. Ejemplos: algunos Nitrobacter spp., Wolinella (con hidrógeno como equivalente reductor), algunas bacterias oxidantes del hidrógeno.
- Los quimioorganoheterótrofos obtienen energía, carbono y equivalentes reductores para las reacciones biosintéticas de compuestos orgánicos. Ejemplos: la mayoría de las bacterias, como Escherichia coli, Bacillusspp., Actinobacteria.
- Los fotoorganotrofos obtienen energía de la luz y el carbono y los equivalentes reductores para las reacciones biosintéticas de compuestos orgánicos. Algunas especies son terminantemente heterótrofas, pero muchas otras pueden también fijar el dióxido de carbono y son mixótrofas. Ejemplos: Rhodobacter, Rhodopseudomonas, Rhodospirillum, Rhodomicrobium, Rhodocyclus, Heliobacterium, Chloroflexus (alterna con fotolitoautotrofía con hidrógeno).
Metabolismo heterótrofo[editar]
La mayoría de los microorganismos son heterótrofos (o más exactamente quimiorganoheterótrofos), con compuestos orgánicos como fuentes de carbono y de energía. Los microorganismos heterótrofos viven de los alimentos que roban a anfitriones vivos (como comensales o parásitos) o de la materia orgánica muerta de todo tipo (saprófagos). Este metabolismo microbiano constituye el principal factor de descomposición de todos los organismos después de muerte. Muchos microorganismos eucariontes son heterótrofos por depredación o parasitismo, características también encontradas en algunas bacterias tales como Bdellovibrio (un parásito intracelular de otras bacterias, causando la muerte de sus víctimas) y algunas Myxobacteria tales como Myxococcus (depredadora de otras bacterias a las que mata y succiona mediante la cooperación de enjambres de numerosas células).
La mayoría de las bacterias patógenas son parásitos heterótrofos de seres humanos o de otras especies eucariontes. Los microorganismos heterótrofos son extremadamente abundantes en naturaleza y responsables de la degradación de los polímeros orgánicos tales como celulosa, quitina o lignina que son generalmente indigeribles para los animales más grandes. Esta degradación, generalmente, requiere la colaboración de varios organismos distintos, cada uno de los cuales realiza uno de los pasos de la degradación hasta obtener dióxido de carbono. Hay muchas variaciones en este tema, pues diversos organismos pueden degradar diversos polímeros y secretar diversos residuos. Algunos organismos pueden incluso degradar los compuestos más recalcitrantes tales como pesticidas y petróleo, realizando su reciclado.
Bioquímicamente, el metabolismo heterótrofo procarionte es mucho más versátil que el de los organismos eucariontes, aunque muchos procariontes comparten los modelos metabólicos más básicos con los eucariontes, por ejemplo, usando la glicolisis (también llamada ruta EMP) para el metabolismo del azúcar y el ciclo del ácido cítrico en la degradacción del acetato, produciendo energía bajo la forma de ATP y reduciendo energía bajo la forma de NADH o quinona. Estas rutas metabólicas básicas están muy extendidas porque también están implicadas en la biosíntesis de muchos componentes necesarios para el crecimiento de la célula (a veces en la dirección contraria). Sin embargo, muchas bacterias y archaea utilizan rutas metabólicas alternativas con la excepción de la glicolisis y del ciclo del ácido cítrico. Un ejemplo bien estudiado es el metabolismo del azúcar por la ruta del ceto-desoxi-fosfogluconato (también llamada ruta ED) en Pseudomonas en vez de la ruta glicolítica. Por otra parte, hay incluso una tercera ruta alternativa catabólica del azúcar usado por algunas bacterias, la ruta de la pentosa fosfato.
Esta diversidad y capacidad metabólicas de los procariontes que les permite utilizar una variedad enorme de compuestos orgánicos se debe a una historia y diversidad evolutivas mucho más profundas que las de los eucariontes. Es también significativo que las mitocondrias se originaron en los eucariontes por endosimbiosis de una bacteria relacionada con los parásitos intracelulares Rickettsia, y también los simbiontes de las plantas Rhizobium o Agrobacterium. Por lo tanto, no es sorprendente que todas las mitocondrias eucariotas compartan características metabólicas con estas Proteobacteria. La mayoría de los microorganismos respiran (usando una cadena de transporte de electrones), aunque el oxígeno no es el único receptor terminal de electrones que puede usarse. El uso de receptores terminales de electrones distintos al oxígeno tiene consecuencias biogeoquímicas importantes.
Fermentación[editar]
La fermentación es un tipo específico de metabolismo heterótrofo que utiliza carbono orgánico en vez de oxígeno como receptor terminal de electrones. Esto significa que estos organismos no utilizan una cadena de transporte de electrones para oxidar NADH a NAD+ y por lo tanto deben tener un método alternativo para usar esta energía reductora y mantener una fuente de NAD+ para el funcionamiento apropiado de las rutas metabólicas normales (por ejemplo, la glicolisis). Puesto que no requieren oxígeno, los organismos fermentantes son anaerobios. Muchos organismos pueden utilizar fermentación bajo ciertas condiciones anaerobias y respiración cuando el oxígeno está presente. Estos organismos son anaerobios facultativos. Para evitar la superproducción de NADH, los organismos fermentantes obligados generalmente no tienen un ciclo completo del ácido cítrico. En vez de usar ATPasas como en la respiración, el ATP en organismos fermentantes es producido por la fosforilación a nivel de sustrato donde un grupo fosfato se transfiere de un compuesto orgánico de gran energía al ADP para formar el ATP.
Como resultado de la necesidad de producir compuestos orgánicos con fosfato de la alta energía (generalmente bajo la forma de CoA-ésteres) los organismos fermentantes utilizan NADH y otros cofactores para producir una gran variedad de subproductos metabólicos reducidos, a menudo incluyendo hidrógeno. Estos compuestos orgánicos reducidos son generalmente ácidos orgánicos cortos y alcoholes derivados del piruvato, el producto final de la glicolisis. Así, existen cuatro tipos principales de fermentación: acética (resultando en acetato), alcohólica (etanol), butírica (buriato) y láctica (lactato). Los organismos fermentantes son muy importantes industrialmente y se utilizan parar elaborar muchos tipos de productos alimenticios. Los productos finales metabólicos producidos por cada especie bacteriana específica son los responsables del gusto y características de cada alimento.
No todos los organismos fermentantes usan fosforilación a nivel de sustrato. En su lugar, algunos organismos son capaces de acoplar directamente la oxidación de compuestos orgánicos de poca energía con la formación de un gradiente electroquímico para mover un protón (o sodio) y así realizar la síntesis de ATP. Ejemplos de estas formas inusuales de fermentación incluyen la fermentación del succinato por el Propionigenium modestum y la fermentación del oxalato por Oxalobacter formigenes. Estas reacciones son de rendimiento energético extremadamente bajo. Los seres humanos y otros animales también utilizan la fermentación para consumir el exceso de NADH produciendo lactato, aunque ésta no es la forma principal de metabolismo como en los microorganismos fermentantes.
Otros tipos de metabolismo específicos[editar]
Metilotrofía[editar]
La metilotrofía se refiere a la capacidad de un organismo para utilizar compuestos C1 como fuentes de energía. Estos compuestos incluyen el metanol, metilaminas, formaldehído y metanoato. Varios otros sustratos menos comunes que carecen de enlaces carbono-carbono también se pueden utilizar para el metabolismo. Ejemplos de metilotrofos son las bacterias Methylomonas y Methylobacter. La metanotrofía es un tipo específico de metilotrofía que puede usar también metano (CH4) como fuente del carbono. El metano es oxidado secuencialmente a metanol (CH3OH), formaldehído (CH2O), metanoato (HCOO- ) y finalmente a dióxido de carbono usando inicialmente la enzima metano-monooxigenasa.
Puesto que se requiere oxígeno para este proceso todos los metanotrofos (convencionales) son aerobios obligados. La reducción de energía se produce en la forma de quinonas y NADH durante la oxidación, lo que origina la fuerza motiva del protón y, por lo tanto, la generación de ATP. Los metilotrofos y metanotrofos no se consideran autótrofos porque suelen incorporar algunos de los metanos oxidados (u otros metabolitos) como carbono celular antes de su oxidación completa a CO2. El carbono se adquiere en el nivel del formaldehído usando la ruta de la serina (Methylosinus, Methylocystis) o la ruta de la ribulosa monofosfato (Methylococcus), dependiendo de la especie de metilotrofo.
Además de la metilotrofía aerobia, el metano se puede también oxidar anaeróbicamente. Esto lo realizan un conjunto de bacterias reductoras del azufre y archaea metanógenas que trabajan sintróficamente. Poco se sabe actualmente sobre la bioquímica y ecología de este proceso.
La metanogénesis es la producción biológica de metano. Es realizada por los metanógenos, archaeas estrictamente anaerobias tales como Methanococcus, Methanocaldococcus, Methanobacterium, Methanothermus, Methanosarcina, Methanosaeta y Methanopyrus. La bioquímica de la metanogénesis es única en la naturaleza por el uso de varios cofactores inusuales que reducen secuencialmente los sustratos a metano. Estos cofactores son responsables (entre otras cosas) del establecimiento de un gradiente protónico a través de la membrana externa que conduce a la síntesis de ATP. Existen varios tipos de metanogénesis que se diferencian en los compuestos iniciales oxidados.
Algunos metanógenos reducen el dióxido de carbono (CO2) a metano (CH4) utilizando usualmente electrones del hidrógeno (H2) quimiolitoautotróficamente. Estos metanógenos se suelen encontrar en ambientes que contienen organismos fermentantes. La colaboración estrecha entre metanógenos y bacterias fermentantes se puede considerar sintrofía porque los metanógenos, que confían en los fermentantes para la obtención del hidrógeno, evitan la inhibición de los mismos impidiendo la excesiva acumulación de hidrógeno. Este tipo de relación sintrófica se denomina concretamente transferencia de hidrógeno entre especies.
Un segundo grupo de metanógenos utiliza metanol (CH3OH) como sustrato para la metanogénesis. Estos organismos son quimioorganotrofos, pero todavía autótrofos porque usan CO2 como única fuente de carbono. La bioquímica de este proceso es bastante diferente de la metanogénesis que reduce el dióxido de carbono. Todos los metanógenos autótrofos utilizan una variación de la ruta del acetilo-CoA para fijar el CO2 y obtener el carbono celular.
Por último, un tercer grupo de metanógenos producen metano y dióxido de carbono a partir de acetato (CH3COO- ) que es partido literalmente entre dos carbonos. Estos organismos rompedores de acetato son los únicos metanógenos quimioorganoheterótrofos.
Sintrofía[editar]
La sintrofía, en el contexto del metabolismo microbiano, se refiere a la colaboración de varias especies para realizar una reacción química que, de otra forma, sería desfavorable energéticamente. El ejemplo mejor estudiado de este proceso es la oxidación de los productos fermentantes finales (tales como acetato, etanol y buriato) por organismos tales como Syntrophomonas. Aisladamente, la oxidación de butirato a acetato e hidrógeno es energéticamente desfavorable. Sin embargo, cuando un metanógeno hidrogenotrofo está presente, el uso del gas de hidrógeno bajará perceptiblemente la concentración del hidrógeno (a 10-5 atmósferas) y desplazará el equilibrio de la reacción de la oxidación del butirato. La energía libre disponible de la metanogénesis baja desde -131 kJ/mol en condiciones estándares a -17 kJ/mol a una presión de hidrógeno de 10-5 atmósferas. Éste es un ejemplo de transferencia de hidrógeno entre especies. De esta manera, las fuentes de energía de bajo rendimiento de carbono pueden ser utilizadas por un consorcio de organismos que realizarán la degradación adicional y eventual mineralización de estos compuestos. Estas reacciones ayudan a prevenir una excesiva pérdida de carbono a la escala de tiempo geológicos, lanzándolo de nuevo a la biosfera en formas usables tales como metano y CO2.
Respiración anaerobia[editar]
En los organismos aerobios el oxígeno es el receptor final de los electrones durante la respiración. Esto es muy eficiente pues el oxígeno tiene un potencial muy bajo de reducción. Los organismos anaerobios utilizan receptores de electrones que tienen un potencial más alto de reducción que el oxígeno, lo que significa que la respiración es menos eficiente y conduce generalmente a tasas de crecimiento más lentas que en los aerobios. Muchos anaerobios facultativos pueden utilizar tanto oxígeno como receptores finales de electrones alternativos para la respiración dependiendo de las condiciones ambientales. La mayoría de los organismos de respiración anaerobia son heterótrofos, aunque hay algunos autótrofos. Todos los procesos que describiremos a continuación son disimilativos, es decir que proporcionan energía pero no nutrientes para la célula (lo que sería asimilativo). Se conocen también las rutas asimilativas de muchas formas de respiración anaerobia.
Desnitrificación[editar]
La desnitrificación es la utilización del nitrato (NO3- ) como receptor terminal de electrones. Es un proceso extensamente distribuido y utilizado por muchos miembros de Proteobacteria. Muchos anaerobios facultativos utilizan la desnitrificación porque el nitrato, como el oxígeno, tiene un bajo potencial de reducción. Muchas bacterias desnitrificadoras pueden también utilizar el hierro férrico (Fe3+ ) y algunos compuestos orgánicos como receptores de electrones. La desnitrificación implica la reducción paso a paso del nitrato al nitrito (NO2- ), al óxido nítrico (NO), al óxido nitroso (N2O) y al nitrógeno (N2) mediante las enzimas nitrato reductasa, nitrito reductasa, óxido nítrico reductasa y óxido nitroso reductasa, respectivamente. Los protones son transportados a través de la membrana por la NADH reductasa, las quinonas y el óxido nitroso reductasa para producir el gradiente electroquímico crítico para la respiración.
Algunos organismos (por ejemplo, E. coli) producen solamente nitrato reductasa y, por lo tanto, solo pueden realizar la primera reducción, lo que lleva a la acumulación del nitrito. Otros (por ejemplo, Paracoccus denitrificans o Pseudomonas stutzeri) reducen el nitrato totalmente. La desnitrificación completa es un proceso ambientalmente significativo porque algunos productos intermedios de la desnitrificación (óxido nítrico y óxido nitroso) son gases importantes que reaccionan con la luz del sol y el ozono para producir ácido nítrico, un componente de efecto invernadero de la lluvia ácida. La desnitrificación es también biológicamente importante en el tratamiento de aguas residuales donde se utiliza para reducir la cantidad de nitrógeno emitida al ambiente de tal modo que reduce la eutroficación.
Reducción del sulfato[editar]
La reducción del sulfato es un proceso energético relativamente pobre usado por muchas bacterias Gram negativas (Proteobacterias gamma) y por organismos Gram positivos relacionados con Desulfotomaculum o con la archaea Archaeoglobus. Como producto final metabólico se obtiene sulfuro del hidrógeno (H2S) . Muchos organismos reductores del sulfato son heterótrofos, empleando compuestos del carbono tales como lactato y piruvato (entre muchos otros) como donadores de electrones mientras que otros son autótrofos, con el gas hidrógeno (H2) como donador de electrones. Algunas bacterias reductoras del sulfato autótrofas inusuales pueden utilizar el fosfito (HPO3- ) como donador de electrones (por ejemplo, Desulfotignum phosphitoxidans) o son capaces de generar dos compuestos a partir del azufre, en este caso un donador de electrones y un receptor de electrón) usando el tiosulfato (S2O32-, por ejemplo, Desulfovibrio sulfodismutans).
Todos los organismos reductores del sulfato son anaerobios obligados. Puesto que el sulfato es energéticamente estable, antes de que pueda ser metabolizado debe primero ser activado por adenilación para formar APS (adenosina 5-fosfosulfato) de tal modo que se consume ATP. El APS es entonces reducido por la enzima APS reductasa a sulfito (SO32- ) y AMP. En los organismos que utilizan compuestos de carbono como donadores de electrones, el ATP consumido es proporcionado por la fermentación del sustrato de carbono. El hidrógeno producido durante la fermentación es realmente quién conduce la respiración durante la reducción del sulfato. Eventualmente, los electrones pasan de la enzima hidrogenasa a la APS reductasa, que junto con la sulfito reductasa termina la reducción del sulfato a sulfuro del hidrógeno. El gradiente que mueve al protón se establece debido al hecho de que la hidrogenasa, que convierte H2 a 2H+, se localiza en el periplasma (o fuera de la célula en las bacterias Gram positivas).
Acetogénesis[editar]
La acetogénesis es un tipo de metabolismo microbiano que utiliza hidrógeno (H2) como donador de electrones y dióxido de carbono (CO2) como receptor de electrones para producir acetato (en esto es similar a la metanogénesis). Las bacterias que pueden sintetizar autotróficamente acetato se denominan homoacetógenas. La reducción del dióxido de carbono en todos los homoacetógenos se produce por la ruta del acetilo-CoA. Esta ruta también es utilizada para la fijación del carbono por las bacterias reductoras del sulfato autótrofas y por los metanógenos hidrogenotrofos. A menudo, los homoacetógenos pueden también ser fermentantes, usando el hidrógeno y dióxido de carbono producidos como resultado de la fermentación para producir acetato, que se secreta como producto final.
Reducción del hierro férrico (Fe3+)[editar]
El hierro férrico es un receptor terminal de electrones extensamente utilizado por los organismos anaerobios autótrofos y heterotrófos. El flujo de electrones en estos organismos es similar a los que usan como receptores terminales oxígeno o nitrato, salvo que en los organismos reductores de hierro férrico la enzima final es la hierro-férrico reductasa. Los organismos modelo incluyen Shewanella putrifaciens y Geobacter metallireducens. Algunas bacterias reductoras del hierro férrico (tales como G. metallireducens) pueden utilizar hidrocarburos tóxicos tales como el tolueno como fuente de carbono, por lo que hay un gran interés en usar estos organismos como agentes de biorremediación en acuíferos contaminados ricos en hierro férrico.
Otros receptores terminales inorgánicos de electrones[editar]
Además de los numerosos y comunes receptores terminales de electrones enumerados arriba, existen algunos organismos que pueden utilizar iones inorgánicos poco comunes en la respiración anaerobia. Mientras que estos procesos pueden ser a menudo menos significativos ecológicamente, son de interés considerable para la biorremediación, especialmente de metales pesados. Los ejemplos incluyen:
- Reducción del ion mangánico (Mn4+ ) al ion manganoso (Mn2+ ).
- Reducción del selenato (SeO42- ) a selenito (SeO32- ) y del selenito a selenio inorgánico (Se).
- Reducción del arseniato (AsO43- ) a arsenito (AsO33- ).
Receptores terminales de electrones orgánicos[editar]
Algunos organismos, en vez de usar compuestos inorgánicos como receptores terminales de electrones en la respiración, puede utilizar compuestos orgánicos. Los ejemplos incluyen:
- Reducción de fumarato a succinato.
- Reducción de óxido trimetil amina (TMAO) a trimetilamina (TMA).
- Reducción de dimetil sulfoxido (DMSO) a dimetil sulfuro (DMS).
- Declorinación reductora.
TMAO es un producto químico producido comúnmente por los peces que cuando se reduce a TMA produce un fuerte olor. DMSO es un producto químico marino y de agua dulce común que también es odorífero cuando se reduce a DMS. La declorinación reductora es el proceso por el cual los compuestos orgánicos con cloro se reducen para formar productos finales sin cloro. Puesto que los compuestos orgánicos que contienen cloro son importantes (y a menudo difíciles de degradar) contaminantes ambientales, la declorinación reductora es un proceso importante en la biorremediación.
Quimiolitotrofía[editar]
La quimiolitotrofía es un tipo de metabolismo en la cual la energía se obtiene de la oxidación de compuestos inorgánicos. La mayoría de los organismos quimiolitotrofos son también autótrofos. La quimiolitotrofía tiene dos funciones importantes: la generación de la energía (ATP) y la generación de potenciales reductores (NADH).
Oxidación del hidrógeno[editar]
Muchos organismos son capaces de usar hidrógeno (H2) como fuente de energía. Previamente se han mencionado varios mecanismos de oxidación anaerobia del hidrógeno (por ejemplo, la reducción del sulfato y las bacterias acetogénicas), pero además el hidrógeno se puede utilizar también como fuente de energía aerobia. En estos organismos, el hidrógeno es oxidado por una hidrogenasa ligada a la membrana, realizando el desplazamiento del protón vía una transferencia de electrones a varias quinonas y citocromos. En muchos organismos se utiliza una segunda hidrogenasa citoplásmatica para generar un potencial reducido bajo la forma de NADH, que se usará posteriormente para fijar el dióxido de carbono vía el ciclo de Calvin. Los organismos que oxidan del hidrógeno, tales como Ralstonia eutrophaeutropha, viven a menudo en las zonas de transición oxigenadas-anóxicas de la naturaleza para aprovechar el hidrógeno producido por los organismos fermentantes anaerobios mientras que todavía pueden acceder al oxígeno.
Oxidación del azufre[editar]
Algunas bacterias oxidan compuestos reducidos de azufre, como sulfuro de hidrógeno (H2S), azufre inorgánico (S0) y tiosulfato (S2O32- ), para formar ácido sulfúrico (H2SO4). Un ejemplo clásico es Beggiatoa, un microbio descrito originalmente por Sergei Winogradsky, uno de los fundadores de la microbiología.
El azufre inorgánico es almacenado interior o exteriormente a la célula hasta que es necesitado. El proceso es posible porque el azufre es energéticamente mejor donante de electrones que el sulfuro inorgánico o el tiosulfato, permitiendo a un número neto de protones atravesar la membrana. Los organismos que oxidan el azufre generan el potencial reductor para la fijación del dióxido de carbono vía el ciclo de Calvin usando el flujo inverso de electrones, un proceso que requiere energía que mueva a los electrones en contra del gradiente termodinámico para producir NADH.
La oxidación del azufre se realiza generalmente en dos etapas. Bioquímicamente, los compuestos de azufre reducidos se convierten en sulfito (SO32- ) que a su vez son transformados posteriormente a sulfato por la enzima sulfito oxidasa. Algunos organismos, realizan la misma oxidación usando un sistema inverso de APS reductasa, invirtiendo el usado por las bacterias reductoras del sulfato (véase arriba). En todos los casos, la energía liberada se transfiere a la cadena de transporte de electrones para la producción de ATP y NADH. Además de la oxidación aerobia del azufre, algunos organismos (por ejemplo, Thiobacillus denitrificans) utilizan nitrato (NO32- ) como receptor terminal de electrones y por lo tanto crecen anaeróbicamente.
Oxidación del hierro ferroso (Fe2+ )[editar]
El hierro ferroso es una forma soluble de hierro estable a un pH extremadamente bajo o bajo condiciones anaerobias. Bajo condiciones aerobias y pH moderado, el hierro ferroso se oxida espontáneamente a la forma férrica (Fe3+ ) y abióticamente a hidróxido férrico (Fe(OH)3 ) insoluble. Existen, por lo tanto, tres tipos distintos de microbios oxidadores del ión ferroso.
El primero es el de acidófilos, tales como las bacterias Acidithiobacillus ferrooxidans y Leptospirrillum ferrooxidans, así como la archaea Ferroplasma. Estos microbios oxidan el hierro en ambientes que tienen un pH muy bajo y son importantes en el drenaje ácido de minas.
El segundo tipo de microorganismos oxida el hierro ferroso a pH neutro en las zonas de transición oxigenada-anóxica. Estas bacterias, tales como Gallionella ferruginea y Sphaerotilus natans, y las bacterias acidófilas oxidantes del hierro son aerobias.
El tercer tipo de microorganismos oxidadores del hierro es el de las bacterias fotosintéticas anaerobias tales como Chlorobium, que utilizan el hierro ferroso para producir NADH para la fijación autótrofa del dióxido de carbono. Bioquímicamente, la reducción aerobia del hierro es un proceso muy pobre energéticamente que por lo tanto requiere la oxidación de grandes cantidades de hierro por enzima rusticianina para facilitar la formación de la fuerza motiva del protón. Durante la oxidación del azufre se necesita un flujo de electrones inverso para producir el NADH usado para la fijación del dióxido de carbono vía el ciclo de Calvin.
Nitrificación[editar]
La nitrificación es el proceso por el cual el amoníaco (NH3) es convertido en nitrato (NO3- ). La nitrificación es realmente el beneficio neto de dos procesos distintos: la oxidación de amoníaco a nitrito (NO2- ) por una bacteria nitrificante (por ejemplo, Nitrosomonas) y la oxidación de nitrito a nitrato por una bacteria nitrito-oxidante (por ejemplo, Nitrobacter). Ambos procesos son extremadamente poco energéticos y llevan a tasas de crecimiento muy lentas para ambos tipos de organismos.
Bioquímicamente, la oxidación del amoníaco ocurre por la oxidación en varios pasos del amoníaco a hidroxilamina (NH2OH) por la enzima amonio monooxigenasa en el citoplasma, seguida por la oxidación de la hidroxilamina a nitrito por la enzima hidroxilamina oxidoreductasa en el periplasma. El ciclo de electrones y protones es muy complejo pero como beneficio neto solamente un protón se desplaza a través de la membrana por cada molécula de amoníaco oxidada.
La reducción del nitrito es mucho más simple: el nitrito es oxidado por la enzima nitrito oxidoreductasa unida al desplazamiento de un protón por una cadena de transporte de electrones muy corta. Esto conduce de nuevo a tasas de crecimiento muy bajas para estos organismos. Se requiere oxígeno tanto para la oxidación del amoníaco como para la del nitrito, lo que implica que las bacterias nitrificantes y oxidadoras de nitrito sean aerobias. Como en la oxidación del azufre y del hierro, el NADH para la fijación del dióxido de carbono en el ciclo de Calvin es generado por un flujo inverso de electrones, poniendo otra carga metabólica a un proceso ya energéticamente pobre.
Anammox[editar]
Anammox denota la oxidación anaerobia del amoníaco, un proceso descubierto recientemente (a finales de los 90). La realizan los miembros de Planctomycetes (por ejemplo, Candidatus Brocadia anammoxidans) e implica el acoplamiento de la oxidación de amoníaco con la reducción de nitrito. Como no se requiere oxígeno para este proceso, estos organismos son estrictamente anaerobios.
Asombrosamente, durante el metabolismo del anammox se produce hidracina (N2H4), un combustible para cohetes como compuesto intermedio. Para ocuparse de la alta toxicidad de la hidracina, las bacterias del anammox contienen un orgánulo intracelular llamado anammoxasoma rodeado por una membrana lípida escalonada y altamente compacta (e inusual) en la que queda confinada la hidracina. La naturaleza de estos lípidos es única, al igual que el uso de hidracina como intermedio metabólico.
Los organismos del Anammox son autótrofos, aunque el mecanismo por el cual realizan la fijación del dióxido de carbono todavía no es conocido. Debido a esta característica, son organismos que se utilizan industrialmente para eliminar el nitrógeno en los procesos del tratamiento de aguas residuales. Estos organismos proliferan extensamente en los sistemas acuáticos anaerobios y se ha especulado que generan aproximadamente el 50% de la producción de gas nitrógeno en algunos ambientes marinos.
Fototrofía[editar]
Muchos microorganismos son capaces de usar la luz como fuente de la energía (fototrofía). De éstos, Cyanobacteria y las algas son particularmente significativas porque son oxigénicas, usando agua como donador de electrones para la transferencia del electrón durante la fotosíntesis. Junto con las plantas, estos microorganismos son responsables de toda la generación biológica de oxígeno sobre la Tierra. En cierto sentido, todos los generadores biológicos de oxígeno descienden de estos microorganismos puesto que los cloroplastos fueron adquiridos por endosimbiosis de un linaje de Cyanobacteria. Así, los principios generales del metabolismo en Cyanobacteria se pueden también aplicar a los cloroplastos.
Además de la fotosíntesis oxigénica, muchas bacterias pueden también fotosintetizar de forma anaerobia, típicamente con sulfuro de hidrógeno (H2S) como donador de electrones para producir sulfato. El azufre inorgánico (S0), tiosulfato (S2O32- ) y el hierro ferroso (Fe2+ ) son también usados por algunos organismos. Filogenéticamente, todas las bacterias fotosintéticas oxigénicas descienden de Cyanobacteria, mientras que las bacterias fotosintéticas anoxígenas pertenecen a las bacterias púrpuras (Proteobacteria), a las bacterias verdes del azufre (por ejemplo, Chlorobium), a las bacterias verdes no del azufre (por ejemplo, Chloroflexus) o a Heliobacteria (bacterias Gram positivas de contenido GC bajo). Además de estos organismos, algunos otros (por ejemplo la archaea Halobacterium o la bacteria Roseobacter, entre otras) pueden utilizar la luz para producir energía usando la enzima bacteriorodopsina. Este tipo de metabolismo no se considera fotosíntesis sino fotofosforilación, puesto que genera energía, pero no fija directamente el carbono.
Como consecuencia de la diversidad de bacterias fotosintéticas, existen numerosos mecanismos por los cuales la luz es convertida en energía para el metabolismo. Todos los organismos fotosintéticos localizan sus centros de reacción fotosintéticos dentro de membranas, que pueden ser invaginaciones de la membrana citoplásmica (bacterias púrpuras), membranas del tilacoide (Cyanobacteria), estructuras en antena especializadas llamadas los clorosomas (las bacterias verdes del azufre y no del azufre) o la membrana citoplásmica en sí misma (heliobacteria). Diversas bacterias fotosintéticas también contienen diversos pigmentos fotosintéticos tales como clorofilas y carotenoides permitiendo que se aprovechen diversas porciones del espectro electromagnético y de este modo habiten diversas zonas. Algunos grupos de organismos contienen estructuras captadoras de luz más especializadas, por ejemplo, ficobilisomas en Cyanobacteria y clorosomas en las bacterias verdes del azufre y no del azufre, aumentando la eficiencia en la utilización de la luz.
Bioquímicamente, la fotosíntesis anoxígena es muy diferente de la fotosíntesis oxigénica. Las Cyanobacteria (y por extensión los cloroplastos) usan un esquema Z de flujo de electrones que es utilizado eventualmente para formar NADH. Se utilizan dos centros reactivos distintos (fotosistemas) y la fuerza motiva del protón es generada usando un flujo cíclico de electrones y quinona. En las bacterias fotosintéticas anoxigénicas el flujo de electrones es cíclico, transfiriendo los electrones de nuevo, una vez empleados en la fotosíntesis, al único centro de la reacción. Se genera la fuerza motiva protón usando solamente quinona. En Heliobacteria y en las bacterias verdes del azufre y no del azufre se forma NADH usando la proteína ferredoxina, una reacción energéticamente favorable. En las bacterias púrpuras se forma NADH mediante el flujo inverso de electrones debido al potencial químico más bajo de este centro de reacción. En todos los casos, sin embargo, se genera y se utiliza la fuerza motiva de un protón para conducir la producción de ATP vía una ATPasa.
La mayoría de los microorganismos fotosintéticos son autótrofos, fijando dióxido de carbono vía el ciclo de Calvin. Algunas bacterias fotosintéticas (por ejemplo, Chloroflexus) son fotoheterótrofos, lo que significa que utilizan compuestos orgánicos como fuente de carbono para el crecimiento. Algunos organismos fotosintéticos también son capaces de fijar nitrógeno.
Fijación de nitrógeno[editar]
El nitrógeno es un elemento requerido para el crecimiento por todos los sistemas biológicos. Aunque es extremadamente común (80% por volumen) en la atmósfera en forma de gas (N2) es generalmente inaccesible biológicamente debido a su alta energía de activación. En toda la naturaleza solamente las bacteriasespecializadas son capaces de la fijación de nitrógeno, convirtiéndolo en amoníaco (NH3) que es asimilado fácilmente por todos los organismos. Estas bacterias, por lo tanto, son muy importantes ecológicamente y son a menudo esenciales para la supervivencia de ecosistemas enteros. Esto es especialmente cierto en el océano, en donde las cyanobacterias fijadoras de nitrógeno son menudo las únicas fuentes de nitrógeno. También es muy importante en el suelo, existiendo simbiosis especializadas entre legumbres y bacterias fijadores de nitrógeno, imprescindibles para el crecimiento de estas plantas.
La fijación de nitrógeno se puede encontrar en casi todos los linajes bacterianos y clases fisiológicas pero no es una característica universal. Puesto que la enzima nitrogenasa, responsable de la fijación de nitrógeno, es muy sensible al oxígeno que la inhibirá irreversiblemente, todos los organismos fijadores de nitrógeno deben tener un cierto mecanismo para mantener la concentración de oxígeno baja. Las posibilidades incluyen:
- Heterocistos en los agregados o filamentos celulares de cyanobacteria (por ejemplo Anabaena) en donde una célula no realiza la fotosíntesis sino que solamente fija el nitrógeno para sus socias que a cambio la proveen de energía.
- Nódulos en las raíces de las plantas (por ejemplo, Rhizobium), en donde la planta le proporciona oxígeno a la bacteria a través de moléculas de leghemoglobina.
- Forma de vida anaerobia (por ejemplo, Clostridium pasteurianum).
- Metabolismo muy rápido (por ejemplo, Azotobacter vinelandii).
La producción y actividad de la nitrogenasa se regula muy en detalle, tanto porque la fijación de nitrógeno es un proceso extremadamente costoso energéticamente (se requieren 16-24 ATPs por N2 fijado) como por la sensibilidad extrema de la nitrogenasa al oxígeno.
No hay comentarios:
Publicar un comentario