ensayos de quimiotaxis son instrumentos experimentales conocidas para la evaluación de la habilidad quimiotáctica de las células procariotas o eucariotas y se aplican una amplia variedad de técnicas para este objetivo.
Algunas de ellas son cualitativas y el investigador puede determinar cual de las células prefiere o no evaluar químicamente. Otras son cuantitativas y podemos obtener información sobre la intensidad de las respuestas en una forma detallada.
Control calidad[editar]
En general el requisito más importante para la evaluación de ambos modelos de células y de, ligando, es calibrar el tiempo de incubación. Un tiempo de incubación corto, no deja células en la muestra y un tiempo demasiado prolongado altera las medidas de concentración de gradientes (sustancias) y las respuestas quimiocinética y quimiotácticas.
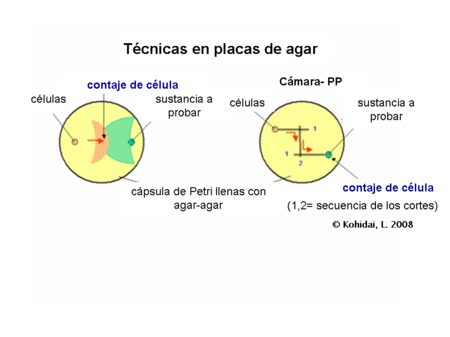
- Técnicas en agar (de placa-agar)
- Conteo de células
Las técnicas más usadas se dividen en dos grupos
Técnicas en placa-agar[editar]
Este tipo de evaluación se trata de cultivos semi sólidos que contienen agar-agar o gelatina lo cual es primordial para el experimento. Pequeñas cantidades son cortadas en capas y llenadas con las células y la sustancia de prueba. Las células pueden migrar hacia el gradiente químico en la capa semi sólida e incluso por debajo de esta también. Algunas variaciones de la técnica tratan también con pozos y canales paralelos conectados entre ellos antes del inicio del experimento (técnica PP).
Una forma radial (circular) de la técnica PP (3 o más canales) nos da la posibilidad de comparar la actividad quimiotáctica entre las diferentes poblaciones celulares o del estudio preferencial entre ligandos.1
Conteo de células[editar]
Las células blanco que responden en forma positiva, podrían ser contadas desde el frente después de la migración de las células, después de la tinción, o en condiciones normales en el microscopio óptico.
Técnica de dos cámaras (two-chamber technique)[editar]
Las cámaras aisladas por filtros son herramientas adecuadas para determinar con exactitud el comportamiento de quimiotaxis. El pionero de este tipo de cámaras fue construido por Boyden.2
Las células móviles se colocan en la cámara superior, mientras que con la sustancia de ensayo disuelta se llena la primera cámara inferior . El tamaño de las células móviles que son investigadas determinan el tamaño del poro del filtro, y esto es esencial para elegir un diámetro que permite una transmigración activa. Para la elaboración de modelos en condición in vivo varios protocolos prefieren una cobertura de filtro con moléculas de la matriz extracelular (ejemplo: colágeno, elastina, etc). La eficiencia de las mediciones se incrementó por el desarrollo de los multipozos “multiwell” (ejemplo, NeuroProbe), en donde 24, 96 y hasta 384 muestras se evalúan en forma paralela. La ventaja de esta variante es que varios ensayos paralelos son realizables en idénticas condiciones.
En otro tipo de cámaras, las mismas están conectadas horizontalmente una al lado de la otra (ejemplo, cámara Zigmond)3 o como anillos concéntricos en una diapositiva (ejemplo, cámara Dunn).4 Se desarrolla un gradiente de concentración en un estrecho puente de conexión entre las cámaras y el número de las células que emigran también se cuenta en el microscopio óptico. En algunos casos, el puente entre las dos cámaras se llena de agar y las células tienen que mantenerse en esta capa semisólida.
Algunas técnicas capilares proporcionan también una cámara como arreglo, sin embargo, ahora hay un filtro entre las células y la sustancia de prueba.5 Se obtienen resultados cuantitativos con esta técnica multipozos “multiwell”. Este tipo de pruebas usa pipetas multicanal de 4-8 y 12 puntas. La precisión de la pipeta y el aumento del número de muestras paralelas es la gran ventaja de esta prueba.6
Conteo de células: las respuestas positivas de las células se cuentan en de la cámara inferior ( después de un largo tiempo de incubación) o desde el filtro (corto tiempo de incubación). Para la detección de células se usan técnicas de tinción (ejemplo, azul de tripano) o sondas especiales (p.ej., mt-deshidrogenasa detección de ensayo con MTT). Las células marcadas (p.ej., fluorocromos) son también usadas, en algunos ensayos las células marcadas se obtienen a través de la transmigración por el filtro.
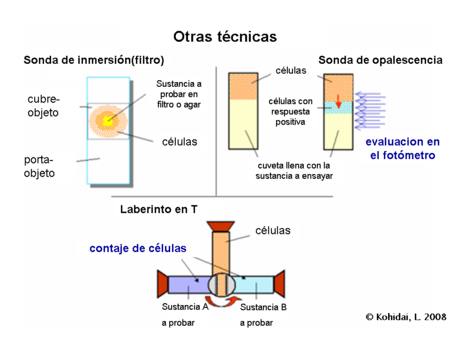
Otras técnicas[editar]
Además de los dos mencionados , de las familias de técnicas de uso común existe una amplia gama de protocolos que fueron desarrollados para medir la actividad de quimiotaxis. Algunas de ellas son sólo cualitativas, como los tests de agregación, cuando los pequeños trozos de filtros o agar se colocan sobre un portaobjetos y se mide la acumulación de células a su alrededor.
En otra técnica semicuantitativa, las células son sobrepuestas en la sustancia de ensayo y los cambios en la opalescencia del compartimiento originalmente libre de células se registran durante el tiempo de incubación.7
La tercera muy frecuentementemente utilizada, sin embargo, es la técnica cualitativa laberinto en T o T-maze y sus adaptaciones de las microplacas. En la versión original el contenedor es perforado, se llena de células. Entonces, la ficha se retuerce y las células logran contactarse con otros dos contenedores llenos de diferentes sustancias. La incubación es para poder emparejar y contar el número de células a partir de los contenedores.8
equilibrio hidrosalino, como parte de la homeostasis, es la correcta proporción de sales (sodio, potasio, calcio y magnesio) y agua en el medio interno.
El agua es el principal componente del organismo y conforma alrededor del 60% del total de los componentes, siendo los sólidos solo el 40% restante. El agua corporal tiene su origen en la ingesta, que es regulada por el sistema nervioso central, y en el metabolismo de glúcidos y lípidos (agua endógena). Las pérdidas de agua corresponden a la eliminación renal obligatoria, la perspiración, el sudor, la evaporación por vía respiratoria, la secreción láctea y las pérdidas por el aparato digestivo. El equilibrio se consigue a través de mecanismos neurofisiológicos (la sed), que aumenta la ingesta, o mecanismos neuroendocrinos, que disminuyen las pérdidas a través de la hormona antidiurética (ADH).
Entre los electrolitos, los más conocidos son el K+, el Na+, el Ca2+ y el Mg2+, que se incorporan con los alimentos. Su presencia en los fluidos orgánicos está regulada por acción hormonal. La concentración de anionesse regula secundariamente a los cationes. Para establecer la normalidad se habla de control iónico o verdad iónica o también anion gap. Anion gap es, por tanto, el término que permite interpretar el ionograma, y corresponde a la diferencia entre cationes y aniones. Su valor usualmente es de 16 mEq/l, y se calcula así:
= ( [Na+]+[K+] ) - ( [Cl-]+[HCO3-] )
esófago de Barrett, también llamado síndrome de Barrett, se refiere a un cambio anormal de las células de la porción terminal del esófago, es decir, una metaplasia, que puede ser el resultado de lesiones debido a exposición al ácido estomacal o por esofagitis de reflujo.1 El esófago de Barrett está presente en un 10% de pacientes que buscan atención médica por reflujo gastroesofágico. Se considera un trastorno pre-maligno, por estar asociado a un cierto riesgo de cáncer del esófago, aunque los enfermos bajo control endoscópico y tratamiento adecuado pueden minimizar ese riesgo.
Etimología[editar]
La condición fue descrita por Phillip Rowland Allison en 1948. El término, esófago o síndrome de Barrett, recibe el nombre por el Dr. Norman Barrett (1903–1979), cirujano británico nacido en Australia que describió el trastorno en 1957.3Etiología[editar]
La principal causa de esófago de Barrett es la Enfermedad por reflujo gastroesofágico (ERGE), la que permite que el contenido del estómago dañe las células que envuelven la superficie del esófago inferior. Sin embargo, no todos los pacientes con ERGE desarrollan un esófago de Barrett. No se ha podido predecir con certeza cuales de los pacientes con pirosis llegará a tener un esófago de Barrett. A pesar de que no hay una relación entre la gravedad de la acidez y la aparición del esófago de Barrett, hay una relación directa entre la pirosis crónica y el desarrollo de un esófago de Barrett. Más aún, algunos pacientes con la metaplasia de Barrett no sufren de agruras o ardores estomacal o esofágico en absoluto. En algunos raros casos, el daño al esófago puede ser causado al ingerir sustancias corrosivas como la lejía.Epidemiología[editar]
La incidencia en los Estados Unidos entre hombres caucásicos es ocho veces el porcentaje entre mujeres caucasianas y cinco veces el del los hombres africanos. Varios estudios han estimado la prevalencia del Esófago de Barrett entre la población normal en un 1.6%,4 1.3%,5 y 3.6%.6Cuadro clínico[editar]
El cambio de células normales a unas pre-malignas indicativo de un esófago de Barrett no es causa de algún síntoma en particular. Sin embargo, algunos signos de alarma deben ser tomados en consideración:
- Acidez estomacal frecuente y de larga duración
- Dificultad para tragar (disfagia)
- Regurgitación sangrienta (hematemesis)
- Dolor retroesternal, en el punto en que el estómago y el esófago se unen
- Pérdida de peso por razón de la dificultad en comer
Patología[editar]
El esófago de Barrett se caracteriza por la presencia de epitelio cilíndrico en la superficie del esófago inferior, reemplazando el característico epitelio escamoso—un cambio ejemplar de una metaplasia. El epitelio cilíndrico esta más calificado para tolerar la acción de las secreciones gástricas, sin embargo, esta metaplasia confiere un aumentado riesgo de adenocarcinoma.7
Las células cilíndricas metaplásicas pueden ser de dos tipos: gástricas—similares a las células estomacales—lo que técnicamente no constituye un esófago de Barrett o células colónicas—similares a las células intestinales, llamada metaplasia intestinal o enteroide, que constituye la metaplasia de Barrett propiamente dicha. Una biopsia del área afectada comúnmente contendrá una mezcla de las dos células. La metaplasia tipo colónica es el tipo de metaplasia asociado al aumentado riesgo de malignidad en personas genéticamente susceptibles.
La metaplasia en el esófago de Barrett es visible grosso modo por medio de un endoscopio, pero las muestras de biopsia deberían ser examinadas bajo un microscopio para determinar si las células constituyentes son de naturaleza gástrica o colónica. La metaplasia colónica se identifica en especial por la presencia de células globulares en el epitelio y su presencia es necesaria para el verdadero diagnóstico de Barrett.
Existen variadas mímicas histológicas del esófago de Barrett, por ejemplo, las células globulares que forman parte del epitelio de transición de los ductos glandulares de la submucosa esofágica normal o las células pseudo-globulares en las que las células tipo mucina del estómago estimulan la aparición de verdaderas células globulares. La revisión de una sospecha de células globulares con glándulas circundantes del tejido estudiado es necesaria para descartar que sean células asociadas a glándulas de la submucosa o efectivamente células globulares de una metaplasia cilíndrica de Barrett. Ocasionalmente el uso de tiniciones histoquímicas, como el azul de Alcian de pH de 2.5, ayudan a distinguir las células de mucina intestinal y otras mímicas celulares. Recientemente, el análisis inmunohistoquímico con anticuerpos en contra de componentes específicos sobre las células de derivación intestinal—como la proteína CDX-2—se han usado para identificar a las células metaplásicas verdaderamente intestinales.
Manejo y tratamiento[editar]
Las recomendaciones actuales incluyen endoscopia y biopsias de rutina (en busca de cambios displásicos) anualmente, mientras que la enfermedad causante es controlada con inhibidores de la bomba de protones (IBP), en conjunto con otras medidas que eviten el reflujo. Los IBP no han probado prevenir el cáncer esofágico. Tratamientos con láser se han usado en displasias severas, y pueden requerir cirugía, radioterapia, o quimioterapia. Actualmente no hay manera de saber qué pacientes con esófago de Barrett desarrollarán cáncer esofágico, pero hay estudios que encontraron tres mutaciones genéticas asociadas con un riesgo de hasta 79% de desarrollar cáncer en 6 años.8
Pronóstico[editar]
El esófago de Barrett sólo es una condición premaligna. Su secuela maligna, el adenocarcinoma esofágico, tiene una mortalidad de sobre el 85%.9 El riesgo de desarrollar cáncer de esófago en personas con esófago de Barrett se ha estimado en 5 por mil personas por año,1011 sin embargo, un estudio de cohortes de 11.028 pacientes de Dinamarca publicó en 2011 una incidencia de 1,2 por mil personas por año (5,1 en pacientes con displasia, 1,0 en pacientes sin displasia).12 Los pacientes con cáncer esofágico suelen tener una sobrevida menor a un año.13
Se ha visto que el riesgo de progresar a displasia de alto grado y cáncer esofágico en pacientes con esófago de Barrett que son fumadores es mayor con respecto a aquellos que nunca han fumado.14
Un estudio publicado en mayo de 2013, por la revista 'Science Traslational Medicine' demuestra la utilidad de tintes celulares para detectar de manera precoz, tumores malignos en pacientes con esófago de Barrett.
Etimología[editar]
La condición fue descrita por Phillip Rowland Allison en 1948. El término, esófago o síndrome de Barrett, recibe el nombre por el Dr. Norman Barrett (1903–1979), cirujano británico nacido en Australia que describió el trastorno en 1957.3
Etiología[editar]
La principal causa de esófago de Barrett es la Enfermedad por reflujo gastroesofágico (ERGE), la que permite que el contenido del estómago dañe las células que envuelven la superficie del esófago inferior. Sin embargo, no todos los pacientes con ERGE desarrollan un esófago de Barrett. No se ha podido predecir con certeza cuales de los pacientes con pirosis llegará a tener un esófago de Barrett. A pesar de que no hay una relación entre la gravedad de la acidez y la aparición del esófago de Barrett, hay una relación directa entre la pirosis crónica y el desarrollo de un esófago de Barrett. Más aún, algunos pacientes con la metaplasia de Barrett no sufren de agruras o ardores estomacal o esofágico en absoluto. En algunos raros casos, el daño al esófago puede ser causado al ingerir sustancias corrosivas como la lejía.
Epidemiología[editar]
La incidencia en los Estados Unidos entre hombres caucásicos es ocho veces el porcentaje entre mujeres caucasianas y cinco veces el del los hombres africanos. Varios estudios han estimado la prevalencia del Esófago de Barrett entre la población normal en un 1.6%,4 1.3%,5 y 3.6%.6
Cuadro clínico[editar]
El cambio de células normales a unas pre-malignas indicativo de un esófago de Barrett no es causa de algún síntoma en particular. Sin embargo, algunos signos de alarma deben ser tomados en consideración:
- Acidez estomacal frecuente y de larga duración
- Dificultad para tragar (disfagia)
- Regurgitación sangrienta (hematemesis)
- Dolor retroesternal, en el punto en que el estómago y el esófago se unen
- Pérdida de peso por razón de la dificultad en comer
Patología[editar]
El esófago de Barrett se caracteriza por la presencia de epitelio cilíndrico en la superficie del esófago inferior, reemplazando el característico epitelio escamoso—un cambio ejemplar de una metaplasia. El epitelio cilíndrico esta más calificado para tolerar la acción de las secreciones gástricas, sin embargo, esta metaplasia confiere un aumentado riesgo de adenocarcinoma.7
Las células cilíndricas metaplásicas pueden ser de dos tipos: gástricas—similares a las células estomacales—lo que técnicamente no constituye un esófago de Barrett o células colónicas—similares a las células intestinales, llamada metaplasia intestinal o enteroide, que constituye la metaplasia de Barrett propiamente dicha. Una biopsia del área afectada comúnmente contendrá una mezcla de las dos células. La metaplasia tipo colónica es el tipo de metaplasia asociado al aumentado riesgo de malignidad en personas genéticamente susceptibles.
La metaplasia en el esófago de Barrett es visible grosso modo por medio de un endoscopio, pero las muestras de biopsia deberían ser examinadas bajo un microscopio para determinar si las células constituyentes son de naturaleza gástrica o colónica. La metaplasia colónica se identifica en especial por la presencia de células globulares en el epitelio y su presencia es necesaria para el verdadero diagnóstico de Barrett.
Existen variadas mímicas histológicas del esófago de Barrett, por ejemplo, las células globulares que forman parte del epitelio de transición de los ductos glandulares de la submucosa esofágica normal o las células pseudo-globulares en las que las células tipo mucina del estómago estimulan la aparición de verdaderas células globulares. La revisión de una sospecha de células globulares con glándulas circundantes del tejido estudiado es necesaria para descartar que sean células asociadas a glándulas de la submucosa o efectivamente células globulares de una metaplasia cilíndrica de Barrett. Ocasionalmente el uso de tiniciones histoquímicas, como el azul de Alcian de pH de 2.5, ayudan a distinguir las células de mucina intestinal y otras mímicas celulares. Recientemente, el análisis inmunohistoquímico con anticuerpos en contra de componentes específicos sobre las células de derivación intestinal—como la proteína CDX-2—se han usado para identificar a las células metaplásicas verdaderamente intestinales.
Manejo y tratamiento[editar]
Las recomendaciones actuales incluyen endoscopia y biopsias de rutina (en busca de cambios displásicos) anualmente, mientras que la enfermedad causante es controlada con inhibidores de la bomba de protones (IBP), en conjunto con otras medidas que eviten el reflujo. Los IBP no han probado prevenir el cáncer esofágico. Tratamientos con láser se han usado en displasias severas, y pueden requerir cirugía, radioterapia, o quimioterapia. Actualmente no hay manera de saber qué pacientes con esófago de Barrett desarrollarán cáncer esofágico, pero hay estudios que encontraron tres mutaciones genéticas asociadas con un riesgo de hasta 79% de desarrollar cáncer en 6 años.8
Pronóstico[editar]
El esófago de Barrett sólo es una condición premaligna. Su secuela maligna, el adenocarcinoma esofágico, tiene una mortalidad de sobre el 85%.9 El riesgo de desarrollar cáncer de esófago en personas con esófago de Barrett se ha estimado en 5 por mil personas por año,1011 sin embargo, un estudio de cohortes de 11.028 pacientes de Dinamarca publicó en 2011 una incidencia de 1,2 por mil personas por año (5,1 en pacientes con displasia, 1,0 en pacientes sin displasia).12 Los pacientes con cáncer esofágico suelen tener una sobrevida menor a un año.13
Se ha visto que el riesgo de progresar a displasia de alto grado y cáncer esofágico en pacientes con esófago de Barrett que son fumadores es mayor con respecto a aquellos que nunca han fumado.14
Un estudio publicado en mayo de 2013, por la revista 'Science Traslational Medicine' demuestra la utilidad de tintes celulares para detectar de manera precoz, tumores malignos en pacientes con esófago de Barrett.


No hay comentarios:
Publicar un comentario