regla de Markovnikov es una observación respecto a la reacción de adición electrófila. Fue formulada por el químico ruso Markovnikov en 1870.12 En una reacción química encontrada particularmente en química orgánica, la regla establece que, con la adición de un reactivo asimétrico del tipo H-X(regularmente un hidrácido) a un alqueno o alquino, el átomo de hidrógeno lábil se une al átomo de carbono del doble o triple enlace con el mayor número de átomos de hidrógeno, y el grupo halogenuro (X) se une al átomo de carbono del doble o triple enlace con el menor número de átomos de hidrógeno.3
Lo mismo es verdad cuando un alqueno reacciona con agua en una reacción catalizada por ácidos minerales, para producir alcoholes. El grupo hidroxilo (OH) se une al átomo de carbono que tiene el mayor número de enlaces carbono-carbono, mientras que el átomo de hidrógeno se une al átomo de carbono en el otro extremo del enlace doble, el que tiene el mayor número de enlaces carbono-hidrógeno.
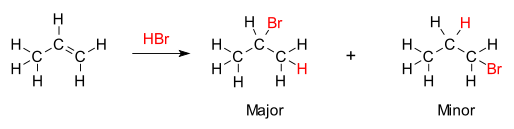
La base química para la regla de Markovnikov es la formación del carbocatión más estable, durante el proceso de adición. La adición del átomo de hidrógeno a uno de los átomos de carbono origina una carga formal positiva en el otro átomo de carbono, formando un carbocatión intermediario. Mientras más sustituido está un carbocatión (más enlaces tiene a otro átomos de carbono u otros sustituyentes electrodonantes), más estable es, debido al efecto inductivo, hiperconjugación e impedimento estérico. El producto principal de la reacción de adición será el que tenga el intermediario más estable. En consecuencia, el producto principal de la adición del HX (donde X es un halógeno, átomo o grupo funcional más electronegativo que el átomo de hidrógeno) a un alqueno tiene el átomo de hidrógeno en la posición menos sustituida y el grupo X en la posición más sustituidas. Es importante notar que, sin embargo, también se formará el carbocatión menos estable, aunque en menor grado, y procederá a formar el producto minoritario con la disposición de átomos en forma opuesta.
Como una mnemotécnica, se puede sumarizar en "el rico se hace más rico y el pobre se hace más pobre": un átomo de carbono rico en sustituyentes ganará más sustituyentes, y el átomo de carbono con más átomos de hidrógeno unidos ganará más átomos de hidrógeno.
Contexto histórico[editar]
Una de las reacciones orgánicas en las que Markovnikov basó su regla fue la que se da entre el yoduro de hidrógeno con el bromuro de vinilo (efectuada por primera vez en 1865). En otra manifestación de su regla, observó que el átomo de halógeno se unió al átomo de carbono que ya llevaba un átomo de halógeno. La hidrólisis de halogenuros germinales del producto inicial de reacción con óxido de plata húmedo o hidrogenado a etanal probó que la sustitución era 1,1.
Se ha observado2 que la publicación original de Markovnikov de 1869 era superficial y que no hizo mucho trabajo experimental por él mismo. La regla en sí apareció sólo como una nota al pie de cuatro páginas en un artículo de 26 páginas,lo que puede ayudar a explicar por qué tómo 60 años que su regla sea aceptada.
Regla de Anti Markovnikov[editar]
Cuando el mecanismo seguido por la reacción impide la formación de un intermediario carbocatión, la reacción puede seguir otros mecanismos que también son regioselectivos, pero en contra de las predicciones de la regla de Markovnikov, como la adición radicalaria. Se dice que tales reacciones son anti-Markovnikov, dado que el átomo de halógeno se une al átomo de carbono menos sustituido. Esta reacción es exactamente opuesta a la reacción de Markovnikov en cuanto a sus resultados, y de ahí el nombre. Nuevamente, del mismo modo que con la carga positiva, el radical es más estable cuando está en la posición más sustituida.
El comportamiento anti-Markovnikov se extiende a otras reacciones químicas distintas a las simples adiciones a los alquenos. Una manifestación anti-Markovnikov se observa en la hidratación del fenilacetileno que, catalizado con oro, produce la acetofenona esperada, pero con un catalizador especial de rutenio4 el otro regioisómero 2-fenilacetaldehído:5
El comportamiento anti-Markovnikov también se puede manifestar en ciertas reacciones de transposición. En una sustitución nucleofílica formal catalizada por cloruro de titanio (IV) en el compuesto 1 enantiopuro en el esquema seguido, se forman los dos productos racémicos 2a y 2b:6
Esta distribución del producto puede ser racionalizada asumiendo que la pérdida del grupo hidroxilo en 1 produce el carbocatión terciario A, que se rearregla al aparentemente menos estable carbocatión secundario B. El cloro puede aproximarse a este centro desde las dos caras, conduciendo a la mezcla observada de isómeros
Sin embargo, tal vez el ejemplo más conocido de adición anti-Markovnikov es la hidroboración.
regla de Záitsev, Zaitsev, Saytzev o Saytzeff establece que en una reacción de eliminación (β-eliminación) en la que pueda ser formado más de un alqueno será mayoritario el más estable termodinámicamente.1
En general, el alqueno más sustituido es el más estable, debido a las propiedades de compartición electrónica de los grupos alquilo con el doble enlace C=C (hiperconjugación). También, en algunos casos, puede incurrir otro efecto estabilizante a la hora de establecer la regioselectividad como es la conjugación del doble enlace con otros grupos.
Esta regla es válida salvo en reacciones de eliminación bimolecular (E2) en las que exista un impedimento estérico importante, sustrato ramificado y/o base voluminosa, y sin posibilidad de conjugación, aplicándose entonces la regla de Hofmann.
Historia[editar]
Aleksandr Mijáilovich Záitsev publicó por primera vez sus observaciones en relación con los productos de las reacciones de eliminación en Justus Liebigs Annalen der Chemie en 1875.23 A pesar de que el artículo contenía algo de investigación original hecha por los estudiantes de Záitsev, era en gran parte una revisión de la literatura y se basó en gran medida sobre trabajos publicados previamente.4 En él, Záitsev propusó una regla puramente empírica para predecir la regioquímica favorecida en la deshidrohalogenación de yoduros de alquilo, a pesar de que resultó que la regla es aplicable también a una variedad de otras reacciones de eliminación. Mientras que el artículo de Záitsev fue bien referenciado a lo largo del siglo XX, hasta la década de 1960 los libros de texto no comenzaron a utilizar el término "regla de Záitsev.3
Curiosamente, Záitsev no fue el primer químico que publicó la regla que ahora lleva su nombre. Aleksandr Nikoláievich Popov publicó una regla empírica similar a la Záitsev en 1872,5 y presentó sus hallazgos en la Universidad de Kazán en 1873. Záitsev había citado el artículo de Popov 1872 en otros artículos anteriores y había trabajado en la Universidad de Kazán, siendo por ello probable que conociera la regla propuesta por Popov. A pesar de esto, el artículo de 1875 en Liebigs Annalen no hace mención del trabajo de Popov.
Regla de Thomson-Helmholtz
La realización de un proceso químico mediante una pila voltáica llevó a suponer que la energía eléctrica producida era igual a la energía química del proceso medida corrientemente por su calor de reacción. Como en ambos casos la reacción se verifica a presión constante (a presión atmosférica), deberá cumplirse:
- Energía eléctrica = Calor de reacción, o sea,
De aquí se tiene:
,
siendo:
- E es la diferencia de potencial de la pila (en voltios),
- Qp es el calor de la reacción expresado necesariamente en joules (1 caloría = 4,1840 joules),
- F es el Faraday (96.496 coulombs) y
- n es el número de equivalentes formados en cada electrodo en la transformación correspondiente al calor Qp de la reacción.
Esta suposición se conoce como la regla de Thomson-Helmholtz, pues fue sugerida en 1851 por William Thomson, más tarde por lord Kelvin, y por Helmholtz.
La regla de Thomson-Helmholtz no es rigurosamente exacta y aunque en general se cumple con bastante aproximación, en algunos casos es errónea.
Historia[editar]
Hermann Ludwig Ferdinand von Helmholtz (1821-1894). Notable médico y famoso físico alemán. Fue cirujano militar primero, profesor de Fisiología en Königsberg (1849), en Bonn (1855) y en Heidelberg (1858) y profesor de Física en Berlín en 1871. Sus valiosas investigaciones se refieren al movimiento de los fluidos y fundamentalmente a la Termodinámica. Formuló de modo preciso el Primer Principio de la Termodinámica (1847), enunciado primeramente en 1842 por el también médico y físico alemán Julius Robert Mayer (1814-1878). Helmholtz fue Presidente del Instituto Nacional de Técnica Física y en el campo médico inventó el oftalmoscopio.
reglas de Woodward-Fieser, nombradas así en honor a Robert Burns Woodward y Louis Fieser, son un conjunto de reglas derivadas empíricamente, que permiten calcular la longitud de onda del máximo de absorción( λmax ) en un espectro UV-visible de un compuesto orgánico dado. Los datos que se ingresan en el cálculo son el tipo de cromóforos presentes, los sustituyentes de los cromóforos, y los corrimientos debido al solvente.12 Algunos ejemplos son los compuestos carbonilo conjugados,34 dienos conjugados,5 y los polienos.4
Implementación[editar]
Un juego de las reglas de Woodward-Fieser para los dienos está indicado en la tabla 1. Un dieno es cualquier homoanular con ambos enlaces dobles contenidos en un anillo, o un heteronuclear con ambos enlaces dobles distribuidos entre los anillos.
| Valor base para un dieno heteronuclear | 214 |
| Valor base para un dieno homonuclear | 253 |
| Incrementos | |
| Enlace doble que extiende la conjugación | + 30 |
| Sustituyente alquilo o residuo de anillo | + 5 |
| Enlace doble exocíclico double bond | + 5 |
| grupo acetato | + 0 |
| grupo éter | + 6 |
| grupo tioéter | + 30 |
| bromo, cloro | + 5 |
| grupo amina terciaria | + 30 |
| Tabla 1. Reglas para la longitud de onda de absorción de dienos (en nanómetros)6 | |
Con la ayuda de estas reglas, puede predecirse la absorción UV máxima, por ejemplo, en estos dos compuestos:7
reglas de Woodward-Hoffmann, propuestas por Robert Burns Woodward y Roald Hoffmann, son un conjunto de reglas en química orgánica que predicen la estereoquímica de las reacciones pericíclicas, basándose en la simetría de los orbitales. Estas incluyen a las reacciones electrocíclicas, cicloadiciones, y reacciones sigmatrópicas. Por este trabajo, en 1981 Hoffmann fue galardonado con el Premio Nobel de Química, compartiéndolo con Kenichi Fukui, quien desarrolló un modelo similar, mientras que Woodward había muerto dos años antes, por lo que no era elegible para ganar el que hubiera sido su segundo Premio Nobel de Química.
Reacción electrocíclica[editar]
Las reglas se aplican a la estereoespecificidad de las reacciones electrocíclica de apertura de anillo y cierre de anillo en el extremo de los polienos conjugados de cadena abierta, tanto por aplicación de calor (reacciones térmicas) o por aplicación de luz (reacciones fotoquímicas). En la publicación original de 1965,1 fueron establecidas tres reglas como:
- En un sistema de cadena abierta que contiene 4n electrones, la simetría de orbital del orbital molecular ocupado más alto en el estado fundamental es tal que una interacción enlazante entre los extremos debe involucrar el traslape entre las regiones de los orbitales en caras opuestas del sistema, y esto puede lograrse solamente mediante un proceso conrotatorio. Un ejemplo de este tipo de reacción es la reacción de ciclización de Nazarov de las divinilcetonas.
- En sistemas abiertos que contienen 4n + 2 electrones, la interacción terminal de enlace entre moléculas en estado basal requiere el traslape de las regiones de los orbitales de la misma cara del sistema, y esto es alcanzable sólo por desplazamientos disrotatorios.
- En una reacción fotoquímica, un electrón en el HOMO del reactante es promovido a un estado excitado, conduciendo a la inversión de las relaciones de simetría terminal, y la inversión de la estereoespecificidad.
Se dice que las reacciones orgánicas que obedecen estas reglas están permitidas por la simetría. Las reacciones que toman el curso contrario son prohibidas por la simetría y requieren mucha más energía para que tengan lugar, si es que llegan a darse.
Las reglas predicen el desenlace de varias reacciones en el estado basal:
- Catión ciclopropilo - catión alilo: disrotatorio
- Radical ciclopropilo - radical alilo: conrotatorio
- Anión ciclopropilo - anión alilo: conrotatorio
- Catión ciclopentadienilo - catión pentadienilo: conrotatorio.
Las reglas mostradas son apoyadas por cálculos teóricos usando el método de Hückel extendido. Por ejemplo, la energía de activación requerida para el la reacción térmica de cierre de anillo del butadieno puede ser calculada como una función de los ángulos de enlace C-C-C, manteniendo las otras variables constantes. Los ángulos mayores de 117° muestran una ligera preferencia para una reacción disrotatoria, pero con ángulos menores se prefiere una reacción conrotatoria.
Una publicación reciente describe cómo puede usarse la tensión mecánica para reformar la trayectoria de una reacción química, para conducir a productos que aparentemente violan las reglas de Woodward-Hoffmann.2
Controversia[editar]
Se ha señalado que el químico E.J. Corey considera que él es el responsable por las ideas que condujeron a realizarse esta investigación, y que Woodward injustamente rechazó darle el crédito respectivo en el descubrimiento. En una memoria publicada en el 2004 en el Journal of Organic Chemistry,3 Corey reclamaba su aportación en la elaboración reglas: "El 4 de mayo de 1964, le sugerí a mi colega R. B. Woodward una explicación sencilla de las conversiones estereoselectivas de ciclobuteno a 1,3-butadieno y de 1,3,5-hexatrieno a ciclohexadieno en la que implicaba la simetría de los orbitales moleculares tipo HOMO, lo que proporcionó la base para idear lo que posteriormente ha sido conocido como las reglas de Woodward–Hoffmann".
Según Corey, que por aquel entonces tenía 35 años, estaba trabajando la noche del lunes 4 de mayo, al igual que Woodward y otros químicos. Hacia las 8:30 p.m., él pasó por la oficina de Woodward, y Woodward le planteó una pregunta sobre cómo predecir el tipo de anillo que formaría una cadena de átomos. Después de algunas discusiones, Corey propuso que la configuración electrónica fuera la que dirigiera el transcurso de la reacción. Aunque Woodward rechazó esta propuesta, Corey dejó algunos esquemas en la oficina, convencido de que estaba en lo cierto 4.
Sentí que esto iba a resultar en un desarrollo realmente interesante, y esperaba poder colaborar en el asunto,escribió. Pero al día siguiente, Woodward entró a la oficina de Corey, mientras él y un colega habían ido a almorzar, y presentando a otros compañeros, como suya (de Woodward), la idea que había tenido Corey. Corey se quedó conmocionado. Dos días después, Woodward habría expuesto la idea en una reunión del grupo.
En una publicación revindicadora del 2004 en Angewandte Chemie,5 Roald Hoffmann negó la declaración de Corey, al referirse a Woodward a partir de una lectura dada en 1966, diciendo: RECUERDO muy claramente, y aún me sorprende ello, el destello crucial de luz que vino hacia mí de una forma algebraica, en vez de pictórica o geométrica. A partir de la idea principal, se me ocurrió que los coeficientes de los términos extremos en la expresión matemática que representa al orbital molecular ocupado más alto del butadieno eran de signo opuesto, mientras que los que corresponden a la expresión del hexatrieno poseían el mismo signo. De ahí, había un paso corto a la visión geométrica, y químicamente más relevante, de que en la ciclización interna de un dieno, la cara superior de un átomo terminal debería atacar la cara inferior del otro, mientras que en el caso del trieno, la formación de un nuevo enlace debería involucrar a ambas caras superiores (o también a la vez las inferiores) de ambos átomos terminales.
Además, Hoffmann señaló que en 2 publicaciones de 19636 y 1965,7 Corey describió una síntesis total del compuesto dihidrocostunolida. Aunque en ella se describe una reacción electrocíclica, Corey no tiene nada qué ofrecer con respecto a explicar su estereoespecificidad. Más aún, es decepcionante que Corey no haya dicho nada de "su" idea por casi 2 décadas después de la muerte de Woodward.
Esta reacción fotoquímica que involucra 4*1+2 electrones es reconocida ahora como conrotatoria.








No hay comentarios:
Publicar un comentario